微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 新型锂离子电池材料Li2MSiO4(M为Fe,Co,Mn,Cu等)是一种发展潜力很大的电池电极材料。工业制备Li2MSiO4有两种方法。
方法一:固相法,2Li2SiO3+FeSO4 Li2FeSiO4+Li2SO4+SiO2。
Li2FeSiO4+Li2SO4+SiO2。
方法二:溶胶-凝胶法,CH3COOLi、Fe(NO3)3、Si(OC2H5)4等试剂 胶体
胶体 干凝胶
干凝胶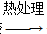 Li2FeSiO4。
Li2FeSiO4。
(1)固相法中制备Li2FeSiO4过程采用惰性气体气氛,其原因是
______________________________________________________________________。
(2)溶胶?凝胶法中,检查溶液中有胶体生成的方法是________;生产中,生成1 mol Li2FeSiO4整个过程转移电子的物质的量为________mol。
(3)以Li2FeSiO4和嵌有Li的石墨为电极材料,含锂的导电固体作电解质,构成电池的总反应式为Li+LiFeSiO4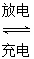 Li2FeSiO4,则该电池的负极是________;充电时,阳极反应的电极反应式为________。
Li2FeSiO4,则该电池的负极是________;充电时,阳极反应的电极反应式为________。
(4)使用(3)组装的电池必须先________。
参考答案:(1)防止Fe2+被氧化成Fe3+ (2)用一束强光照射溶液,从侧面能观察到一条光亮的通路 1 (3)嵌有Li的石墨 Li2FeSiO4-e-=LiFeSiO4+Li+ (4)充电
本题解析:(1)Fe2+易被氧化成Fe3+,加热时需隔绝空气。(2)胶体的特性是丁达尔效应。根据Fe(NO3)3~e-~Li2FeSiO4,生成1 mol Li2FeSiO4转移1 mol电子。(3)负极失电子发生氧化反应,应是嵌有Li的石墨作负极。Li2FeSiO4在阳极失电子发生氧化反应。(4)该电池组装后没有LiFeSiO4,所以不能放电,充电后产生LiFeSiO4才可以放电。
本题难度:一般
2、选择题 电子表所用的某种纽扣电池的电极材料为Zn和Ag2O,电解质溶液是KOH溶液。电池总反应式为:Zn+Ag2O="ZnO+2Ag," 下列说法错误的是?(?)
A.该电池的正极是Ag2O,负极是Zn
B.该电池负极的电极反应式为:Zn+2OH——2e—=ZnO+H2O
C.理论上该电池工作一段时间后,溶液中KOH的浓度不变
D.该电池工作时,电解质中的阴离子向正极移动
参考答案:D
本题解析:略
本题难度:简单
3、选择题 镍镉电池在通讯、交通及日常生活中有着广泛的应用,其工作原理可以表示为:Cd+2NiO(OH)+2H2O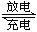 2Ni(OH)2+Cd(OH)
2Ni(OH)2+Cd(OH) 2以下说法中正确的是:(?)
2以下说法中正确的是:(?)
A.以上反应是可逆反应
B.放电时,镉为正极
C.充电时电池上标有“+”号的电极连接电源负极
D.以镍镉电池为电源,电解Na2CO3溶液,当收集到气体的总体积为33.6L(标况下)时,电池中转移了2mol电子
参考答案:D
本题解析:略
本题难度:简单
4、填空题 (14分)
(1)最早使用的化学电池是锌锰电池,即大家熟悉的干电池。这种电池在使用过程中,锌外壳会逐渐变薄,最后内部糊状的电解质会泄漏出来,使电器腐蚀。后来人们采用了什么方法将其改造成了防漏电池。请列举一种方法即可_____________。
这种电池还有一个缺点:即使不用,放置过久,也会失效,请说明失效的原因_________。
(2)为提高电池寿命和提高其性能,人们将电池内的电解质NH4Cl换成湿的KOH,并在构造上做了改进,制成了碱性锌锰电池。其总反应为:
Zn + 2MnO2 + 2H2O ="===" 2MnOOH + Zn(OH)2
写出该电池正极反应式___________。电池工作时,电子流向?(填“正”或“负”)极。
(3)二氧化锰是制造锌锰干电池的基本材料。MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是?。若电解电路中通过2mol电子,MnO2的理论产量为?。
(4)生产MnO2另一种方法:以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰。流程如下:

某软锰矿的主要成分为MnO2,还含有Si(16.72%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
沉淀物
| Al(OH)3
| Fe(OH)3
| Fe(OH)2
| Mn(OH)2
| Cu(OH)2
| Zn(OH)2
| CuS
| ZnS
| MnS
| FeS
|
pH
| 5.2
| 3.2
| 9.7
| 10.4
| 6.7
| 8.0
| ≥–0.42
| ≥2.5
| ≥7
| ≥7
|
①硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式
为?。
②加入MnS的目的是除去?杂质。
参考答案:
(1)在外壳套上防腐金属筒或塑料筒? 1分
作为电解质的NH4Cl的水溶液会水解使溶液显酸性2分
(2)MnO2+H2O+e-=MnOOH+OH-? 2分?正极? 1分
(3)2H++2e-=H2↑?2分? 87g?2分
(4)①MnO2+2FeSO4+2H2SO4=MnSO4+Fe2(SO4)3+2H2O? 2分
②Cu2+? Zn2+?各1分
本题解析:略
本题难度:一般
5、选择题 甲醇(CH3OH)广泛用于作燃料电池的燃料,可用天然气来合成。已知
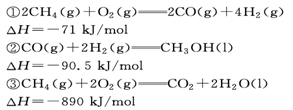
下列说法不能得出的结论是:
A.反应不需要加热就能进行
B.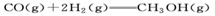 ,
,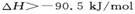
C.甲醇的燃烧热为:
D.若CO的燃烧热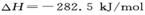 ,则氢气的燃烧热
,则氢气的燃烧热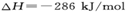
参考答案:A
本题解析:放热反应在常温下不一定能自发进行,即反应条件与反应是放热还是吸热无关,选项A不正确。应用气态甲醇的能量高于液态甲醇的能量,所以生成液态甲醇放热多,但放热越多,反应热越小,B正确。燃烧热是指在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时,所放出的能量。因此。③×2-①-②×2得到2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)?△H=-1528kJ/mol,选项C正确。③×2-①得到2CO(g)+4H2(g)+3O2(g)=2CO2(g)+4H2O(l)?△H=-1709kJ/mol.又因为2CO(g)+O2(g)=2CO2 (g)?△H=-565kJ/mol,所以二者合并即得到4H2v+2O2(g)=4H2O(l) △H=-1144kJ/mol,D正确。答案选A。
本题难度:简单