微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题
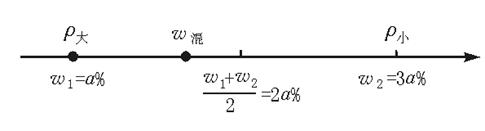
A.>2a%
B.<2a%
C.=2a%
D.无法确定
参考答案:B
本题解析:
本题难度:一般
2、选择题 常温常压下,两个容积相同的烧瓶中分别盛满X和Y两种气体,打开开关a,使两烧瓶内的气体相通,最后容器内的压强由大到小的顺序排列正确的是
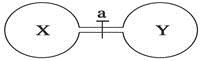
编号
| ①
| ②
| ③
| ④
|
气体X
| HI
| NH3
| H2
| NO
|
气体Y
| Cl2
| HCl
| Cl2
| O2
|
?
A.②>③>①>④?B.③>①=④>②
C.③>①>④>②?D.④>①>②>③
参考答案:C
本题解析:审题时要注意三个问题:一是气体X与Y可能反应,二是压强大小比较需要应用阿伏加德罗定律,三是注意2NO2 N2O4的转化。同温同体积,气体的压强之比等于物质的量之比。设起始状态下,每个烧瓶中气体的物质的量为a mol。①中Cl2+2HI=2HCl+I2,常温下,碘呈固态,充分反应后,气体的物质的量为1.5a mol。②中NH3+HCl=NH4Cl,反应后无气体。③中不反应(光照或点燃条件下才反应)。④中发生反应2NO+O2=2NO2,2NO2
N2O4的转化。同温同体积,气体的压强之比等于物质的量之比。设起始状态下,每个烧瓶中气体的物质的量为a mol。①中Cl2+2HI=2HCl+I2,常温下,碘呈固态,充分反应后,气体的物质的量为1.5a mol。②中NH3+HCl=NH4Cl,反应后无气体。③中不反应(光照或点燃条件下才反应)。④中发生反应2NO+O2=2NO2,2NO2 N2O4,反应后气体的物质的量介于a mol与1.5a mol之间。答案选C。
N2O4,反应后气体的物质的量介于a mol与1.5a mol之间。答案选C。
本题难度:一般
3、选择题 下列实验现象描述正确的是
[? ]
A.碘水中加入少量汽油振荡,静置后上层颜色变浅,下层颜色变为紫红色
B.红热的铜丝在氯气中燃烧,产生了棕黄色的烟雾
C.电解氯化钠饱和溶液,将阴极气体产物通入碘化钾淀粉溶液中,溶液变蓝
D.溴化钠溶液中加入少量新制的氯水振荡,再加入少量四氯化碳振荡,静置后上层颜色变浅,下层颜色变为橙红色
参考答案:D
本题解析:
本题难度:一般
4、简答题 (2014届上海市八校高三年级联合调研考试化学试卷)
为了预防碘缺乏症,国家规定每千克食盐中应含40~50mg碘酸钾。碘酸钾晶体有较高的稳定性,但在酸性溶液中,碘酸钾是一种较强的氧化剂,能跟某些还原剂作用生成碘;在碱性溶液中,碘酸钾能被氯气、次氯酸等强氧化剂氧化为更高价的碘的含氧酸盐。
【问题1】工业生产碘酸钾的流程如下:?
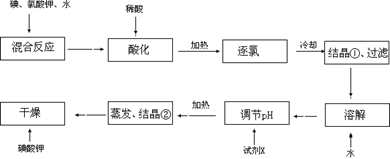
(1)碘、氯酸钾和水混合后的反应为(未配平):I2+KClO3+H2O→KH(IO3)2+KCl+Cl2↑。该方程式配平时,系数有多组,原因是??。
(2)X的化学式为?;写出用试剂X调节pH的化学方程式:?。
(3)生产中,如果省去“酸化”、“逐氯”、“结晶①、过滤”这三步操作,直接用试剂X调整反应后溶液的pH,对生产碘酸钾有什么具体影响???。
【问题2】已知:KIO3+5KI+3H2SO4→3K2SO4+3I2+3H2O;? I2+2S2O32-→2I-+S4O62-。
(4)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应。用四氯化碳检验碘单质时,看到的明显现象有?。
(5)测定加碘食盐中碘的含量,学生乙设计的实验步骤如下:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL恰好反应。
则加碘食盐样品中的碘元素含量是?mg/kg(以含w的代数式表示)。
(6)学生丙又对纯净的NaCl(不含KIO3)进行了下列实验:
操作步骤
| 实验现象
|
取1g纯净的NaCl,加3mL水配成溶液。
| 溶液无变化
|
滴入5滴淀粉溶液和1mL 0.1 mol·L-1 KI溶液,振荡。
| 溶液无变化
|
然后再滴入1滴1mol·L-1的H2SO4,振荡。
| 溶液变蓝色
|
?
①推测实验中产生蓝色现象的可能原因,用离子方程式表示?。
②根据学生丙的实验结果,请对学生乙的实验结果作出简要评价:?。
参考答案:
(1)有两种还原产物生成。
(2)KOH;? KH(IO3)2+KOH=2KIO3+H2O?
(3)反应产生的氯气跟KOH反应生成KClO, KClO能将KIO3氧化成KIO4从而不能得到碘酸钾。
(4)液体分层,下层液体呈现紫红色。
(5)1270/3W或 (423.33/W)。
(6)①4I-+4H++O2→2I2+2H2O;② 因加入了过量KI溶液,乙实验结果会偏大。
本题解析:
(1)碘、氯酸钾和水混合后的反应为(未配平):I2+KClO3+H2O→KH(IO3)2+KCl+Cl2↑。该反应是氧化还原反应,由于在氧化还原反应中电子转移数目相等,而有两种还原产物生成。它们相对量的多少不同,配平时的系数就不同。因此在该方程式配平时,系数有多组。
(2)晶体①为KH(IO3)2,把晶体从溶液中过滤出来,洗涤干净,然后用水溶解得到KH(IO3)2的溶液,要把酸式盐变为正盐KIO3,就要加碱来调节溶液的pH值。为了不引入新的杂质,所以要用KOH。该反应的方程式为KH(IO3)2+KOH=2KIO3+H2O
(3)反应I2+KClO3+H2O→KH(IO3)2+KCl+Cl2↑产生的氯气跟KOH反应生成KClO, KClO能将KIO3氧化成KIO4从而不能得到碘酸钾。导致操作失败,前功尽弃。
(4)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应KIO3+5KI+3H2SO4→3K2SO4+3I2+3H2O。由于I2容易溶解在四氯化碳而不容易溶解在水中,水与四氯化碳互不相溶,CCl4的密度比水大,I2溶解在CCl4中而使溶液呈紫色.所以用四氯化碳检验碘单质时,看到的明显现象有液体分层,下层液体呈现紫红色。
(5)由方程式得关系式:KIO3~3I2~6S2O32-.n(S2O32-)=2.0×10-3mol/L×0.010L=2.0×10-5mol.所以n(KIO3)= 2.0×10-5mol÷6=1/3×10-5mol.m(I)= (1/3×10-5mol)×127g/mol=127/3×10-5g=127/3×10-2mg.所以在该加碘食盐中碘的含量为m(I)÷m(总)= 127/3×10-2mg÷W×10-3kg=1270/3W mg/kg。
(6)① 该食盐中无KIO3,而实验中产生蓝色现象的可能是空气中的氧气在酸性条件下把I-氧化为I2单质。4KI+2H2SO4+O2=2K2SO4+3I2+3H2O。碘单质遇淀粉变蓝色。该反应的离子方程式为4I-+4H+ +O2=2I2+2H2O。②乙的实验中加入过量KI溶液,根据学生丙的实验结果,可知空气中的氧气也会导致产生一部分的碘单质。所以学生乙的实验结果比真实值会偏大。
本题难度:一般
5、选择题 下列关于新制氯水的叙述中不正确的是( )
A.新制氯水中含有的分子包括Cl2、H2O,含有的离子包括H+、Cl-、ClO-
B.新制氯水在光照下分解释放出无色气体
C.新制氯水放置数天后漂白能力变弱
D.新制氯水滴在蓝色石蕊试纸上先变红后褪色
参考答案:Cl2+H2O=H++Cl-+HClO,所以氯水中的成分为Cl2、HClO、H2O、Cl-、H+、OH-、ClO-,2HClO光照.2HCl+O2↑,
A.氯水中存在的分子有Cl2、HClO、H2O,存在的离子有 Cl-、H+、OH-、ClO-,故A错误;
B.2HClO光照.2HCl+O2↑,所以光照时有无色气体生成,故B正确;
C.次氯酸不稳定,光照易分解导致次氯酸浓度降低,所以新制氯水放置数天后漂白能力变弱,故C正确;
D.氯水溶液呈酸性,所以能使蓝色石蕊变红色,次氯酸有漂白性,能使溶液褪色,故D正确;
故选A.
本题解析:
本题难度:简单