微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 氮是地球上含量丰富的原子元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)25℃时,0.1mol/LNH4NO3溶液中水的电离程度?(填“大于”、“等于”或“小于”) 0.1mol/L NaOH溶液中水的电离程度。
(2)若将0.1mol/L NaOH溶液和0.2mol/LNH4NO3溶液等体积混合,混合溶液中2c(NH4+)>c(NO3-),所得溶液中离子浓度由大到小的顺序是?。
(3)发射火箭时肼(N2H4)为燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。经测定16g气体在上述反应中放出284kJ的热量。则该反应的热化学方程式是?。
(4)下图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图。
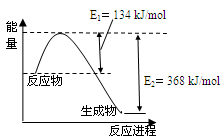
已知:N2(g)+O2(g)=2NO(g)?△H=+180kJ/mol
2NO (g)+O2(g)=2NO2(g)?△H=-112.3kJ/mol
则反应:2NO(g)+2CO(g) N2(g)+2CO2(g)的△H是?。
N2(g)+2CO2(g)的△H是?。
参考答案:(1)大于?(2)c(NO3-)>c(NH4+)>c(Na+)>c(OH-)>c(H+)
(3)2N2H4(g)+2NO2(g)=3N2(g)+2H2O (g)?△H=-1136kJ/mol(4)-760.3kJ/mol
本题解析: (1)酸、碱抑制水的电离、能水解的盐促进水的电离。
(2)0.1mol/L NaOH溶液和0.2mol/LNH4NO3溶液等体积混合后c(Na+)=0.05mol/L、c(NO3-)=0.1mol/L,由2c(NH4+)>c(NO3-)得c(NH4+)>0.05mol/L。电荷守恒式为c(Na+)+c(NH4+)+c(H+)=c(NO3-)+c(OH-),由c(Na+)、c(NO3-)、c(NH4+)得c(OH-)>c(H+)。所以c(NO3-)>c(NH4+)>c(Na+)>c(OH-)>c(H+)。
(3)2N2H4+2NO2=3N2+2H2O,16gN2H4为0.5mol,所以2molN2H4反应放热1136kJ。
(4)由图像可得NO2(g)+CO(g) CO2(g)+NO(g)?△H=-234kJ/mol。由盖斯定律得2NO(g)+2CO(g)
CO2(g)+NO(g)?△H=-234kJ/mol。由盖斯定律得2NO(g)+2CO(g) N2(g)+2CO2(g)的△H=-(234×2+180+112.3)kJ/mol=-760.3kJ/mol。
N2(g)+2CO2(g)的△H=-(234×2+180+112.3)kJ/mol=-760.3kJ/mol。
本题难度:一般
2、选择题 下列各分子中所有原子都满足最外层为8电子结构的是(?)
A.N2
B.BF3
C.PCl3
D.HCl
参考答案:A
本题解析:略
本题难度:简单
3、填空题 (1)一切化学反应除了有质量的变化外,还伴随着________ 的变化,它们分别遵循________定律和________ 定律。能量变化主要表现为_______的变化,即_______或者________。
(2)____既是化学反应过程的本质,又是化学反应中能量变化的主要原因。从能量的角度看,断开化学键要_______,形成化学键要_______。一个化学反应是吸收能量(热量)还是放出能量(热量),取决于________。
(3)不同的物质不仅组成不同、结构不同,所包含的________ 也不同。从反应物和生成物所具有的能量角度看,放热反应是指_______的反应,从化学键角度看,放热反应是_______ 的反应。
参考答案:(1)能量;质量守恒;能量守恒;热量;放热;吸热
(2)化学键的断裂与形成;吸收能量;放出能量;断开化学键吸收的能量和形成化学键释放的能量的相对大小
(3)化学能;反应物的总能量高于生成物的总能量;断开化学键吸收的能量小于形成化学键放出的能量
本题解析:
本题难度:一般
4、选择题 下列说法正确的是( )
A.需要加热的反应一定是吸热反应
B.所有的化学反应都有能量变化
C.所有的放热反应都可以在常温常压下自发进行
D.核能作为一种反应热,是理想的新能源