| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《离子方程式的书写及正误判断》高频试题特训(2017年最新版)(六)
参考答案:D 本题解析:A、澄清石灰水与少量小苏打溶液混合:Ca2+ +OH- +HCO3- = CaCO3↓+ H2O,错误;B、氨水不会将生成的氢氧化铝沉淀溶解,错误;C、得到的是碳酸氢根离子,错误;D、正确。 本题难度:困难 3、选择题 能正确表示下列反应的离子反应方程式为 |
参考答案:B
本题解析:A、醋酸为弱酸,不能拆成离子,故A错误;B、向FeBr2溶液中通入足量氯气,生成Fe3+、Br2、Cl?,配平可得离子方程式:2Fe2+ + 4Br- + 3Cl2=== 2Fe3+ + 2Br2 + 6Cl-,故B正确;C、NH4HCO3溶于过量的NaOH溶液中,NH4+、HCO3?均与OH?反应,故C错误;D、向明矾(KAl(SO4)2·12H2O)溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全,生成BaSO4沉淀和AlO2-,故D错误。
考点:本题考查离子方程式的书写。
本题难度:一般
4、选择题 能正确表示下列反应离子方程式的是
A.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2=2NH4++SO32-+H2O
B.Na2S2O3溶液中加入稀盐酸:2S2O32-+2H+=SO42-+3S↓+H2O
C.氢氧化镁与稀盐酸反应:H++OH-=H2O
D.Ba(OH)2溶液与稀硫酸反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O
参考答案:A
本题解析:A.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2=2NH4++SO32-+H2O,A正确;B.Na2S2O3溶液中加入稀盐酸:S2O32-+2H+=SO2↑+3S↓+H2O,B错误;C.氢氧化镁与稀盐酸反应:2H++Mg(OH)2=2H2O+Mg2+,C错误;D.Ba(OH)2溶液与稀硫酸反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,D错误,答案选A。
考点:考查离子方程式正误判段
本题难度:一般
5、填空题 (10分)下图中,A、B、C、D、E是常见单质,其中B、C、E为金属。G、H、I、F是B、C、D、E分别和A形成的化合物,G物质有磁性。已知:①C与G反应生成B和H且放出大量的热,该反应可用于焊接铁轨;②I是一种常见的温室气体,它和E可以发生反应: ,F中E元素的质量分数为60%。回答问题:
,F中E元素的质量分数为60%。回答问题:
(1)C与G反应的化学方程式为 ;
(2)单质A的分子式为 ,化合物I的名称为 ;
(3)C与NaOH溶液反应的化学方程式为 ;
(4)过量I与NaOH溶液反应的离子方程式为 ;
参考答案:(1)8Al+ 3Fe3O4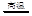 9Fe+ 4Al2O3 (2)O2,二氧化碳
9Fe+ 4Al2O3 (2)O2,二氧化碳
(3)2Al + 2H2O + 2NaOH ="=" 2NaAlO2 + 3H2 (4)CO2 + OH-== HCO3-
本题解析:(1)A、B、C、D、E是常见单质,其中B、C、E为金属。C与G反应生成B和H且放出大量的热,该反应可用于焊接铁轨;则为铝热反应,C与G反应的化学方程式为8Al+ 3Fe3O4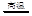 9Fe+ 4Al2O3
9Fe+ 4Al2O3
(2)G、H、I、F是B、C、D、E分别和A形成的化合物,G物质有磁性,为Fe3O4则A为氧气,化学式为O2,I是一种常见的温室气体,是二氧化碳。
(3)C为铝,铝与NaOH溶液反应的化学方程式为2Al +2H2O +2NaOH ==2NaAlO2 +3H2;
(4)过量的CO2与NaOH溶液反应的离子方程式为CO2 + OH-==HCO3-。
考点:考查物质的推断。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《化学反应与.. | |