微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (14分)某课外兴趣小组的同学向Na2SiO3溶液中滴加盐酸,预计会生成H2SiO3胶体,用激光笔照射会出现“丁达尔现象”。但令人意想不到的是,试管中在出现硅酸胶体的同时也出现了大量气泡,为什么会出现这种现象呢?甲乙两同学进行了大胆的推测。
甲同学推测是生成了硅酸胶体,造成HCl在溶液中的溶解度变小,最终从溶液中逸出;
乙同学咨询了实验员得知这瓶Na2SiO3溶液已经放置很长一段时间,他推测溶液可能已经变质,故导致以上现象的出现。
(1)请设计一个最简单的实验验证甲同学的推测是否正确:?;
(2)乙同学取这瓶久置的硅酸钠溶液,用激光笔照射,发现有光柱出现,说明在这瓶硅酸钠溶液中已经有?胶体生成。推测产生的气体可能是?,然后乙同学又做了两个实验进行验证:
I取少量该瓶溶液,向其中滴加?,并检验产生的气体。请写出检验该气体的常用方法:?;
II取硅酸钠固体,配成饱和溶液,现配现用,滴入盐酸,观察现象;
通过以上实验,证明了乙同学观点,请写出所对应的化学反应方程式:
?、?;
该小组同学还发现按教材所述的操作方法和条件制备硅酸胶体,有时需要很长时间才能使溶胶慢慢凝聚,甚至不易形成凝胶,效果很不理想。因此,该组同学又对实验条件和操作进行探究,相关实验数据如下表:
?
| 硅酸钠溶液浓度
| 盐酸浓度
| 试剂加入顺序
| 出现凝胶时间(s)
|
实验1
| 饱和溶液
| 1:2(盐酸和水体积比,下同)
| 将Na2SiO3溶液滴加到稀盐酸中
| 21
|
实验2
| 稀溶液(1体积饱和溶液和3体积水混合)
| 1:2
| 将稀盐酸滴加到Na2SiO3溶液中
| 38
|
实验3
| 饱和溶液
| 1:4
| 将Na2SiO3溶液滴加到稀盐酸中
| 10
|
实验4
| 稀溶液(1体积饱和溶液和3体积水混合)
| 1:4
| 将稀盐酸滴加到Na2SiO3溶液中
| 50
|
该组部分同学通过实验得出结论:使用饱和Na2SiO3溶液和稀盐酸,将Na2SiO3溶液滴加到稀盐酸中效果较好。但该组另外一部分同学认为基于限定的条件,该探究实验设计组数不够,不能保证结论的准确性,要使实验具有说服力至少要做组实验。
参考答案:(14分)

本题解析:略
本题难度:一般
2、填空题 某同学利用铁与水蒸气反应后的固体物质进行了如下实验:
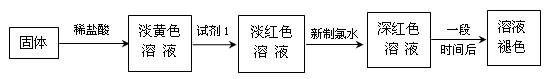
(1)固体溶于稀盐酸的化学方程式为?;
(2)试剂1的化学式是?;加入试剂1后呈红色的原因是(用离子方程式表示):?。
(3)加入新制氯水后溶液红色加深的原因是(用离子方程式表示)?;
(4)某一同学在实验中由于加入了过量新制氯水,放置一段时间后,发现深红色褪去,为了探究溶液褪色的原因,另有四位同学进行了下表的猜想,你认为丁同学的猜想会是什么?
编 号
| 猜?想
|
甲
| 溶液中的+3价Fe又被还原为+2价Fe
|
乙
| 溶液中的SCN-被过量的氯水氧化
|
丙
| 新制的氯水具有漂白性,将该溶液漂白
|
丁
| ???
|
为验证乙同学的猜想合理与否?请同学们根据结论完成下表的实验设计方案。可选用试剂:浓硫酸、1.0mol·L-1HNO3、1.0mol·L-1盐酸、1.0 mol·L-1 NaOH、0.1mol·L-1FeCl3、0.1mol·L-1CuSO4、20%KSCN、蒸馏水。
实验操作
| 预期现象
| 结 论
|
?
| ?
| 说明乙同学的猜想是合理的
|
?
参考答案:(1)Fe3O4 + 8HCl ="=" 2FeCl3 + FeCl2 + 4H2O?(3分)
实验操作
预期现象
只答对其中一方面均可得分
取少量褪色后的溶液,滴加20%KSCN溶液 (3分)
如果溶液变红色 (2分)
或取少量退色后溶液,加入0.1mol·L-1FeCl3溶液
或如果溶液不变红色
本题解析:略
本题难度:简单
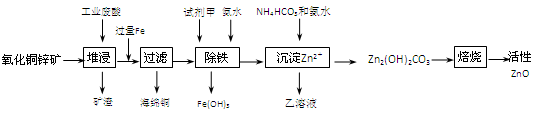
3、填空题 (14分)某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿制取活性ZnO的方案,实现废物综合利用,方案如下图所示。
已知:298K时各离子开始沉淀及完全沉淀时的pH如下表所示。
离子
| 开始沉淀时的pH
| 完全沉淀时的pH
|
Fe2+
| 6.34
| 9.7
|
Fe3+
| 1.48
| 3.2
|
Zn2+
| 6.2
| 8.0
|
请回答下列问题:
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,这是由于相同温度下:Ksp(CuS)??Ksp(ZnS)(选填“>”“<”或“=”)。
(2)你认为在除铁过程中选用下列物质中的?(填序号)作为试剂甲是比较合适的。
A.KMnO4? B.HNO3? C.H2O2? D.Cl2
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在?范围之间。
(4)请写出加甲物质后,加入氨水控制调节溶液的pH下生成Fe(OH)3反应的离子方程式?。
(5)298K时,残留在乙溶液中的c(Fe3+)在 __??mol/L以下。
[Fe(OH)3的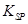 = 2.70×10-39]
= 2.70×10-39]
(6)乙的溶液可直接用作氮肥,则乙的化学式是?。
(7)请写出“沉淀Zn2+”步骤中发生反应的化学方程式?。
参考答案:(1)<?(2)C?(3)3.2~6.2
(4)Fe3++3NH3·H2O ="==" Fe(OH)3↓+3 NH4+
(5)2.7×10-20.4
(6)(NH4)2SO4
(7)2ZnSO4 +NH4HCO3 +3 NH3·H2O="=" Zn2(OH)2CO3 ↓+2(NH4)2 SO4 + H2O
本题解析:(1)ZnS和CuS均存在溶解平衡:ZnS(s) ZnS(aq)=Zn2++S2-? CuS(s)
ZnS(aq)=Zn2++S2-? CuS(s) CuS(aq)=Cu2++S2-,当c(H+)增大的情况下,c(S2-)减小的情况下,前者平衡正向移动,即离子积c(Zn2+)×c(S2-)小于Ksp(ZnS),并且离子积c(Cu2+)×c(S2-)大于Ksp(CuS),则Ksp(ZnS)较大
CuS(aq)=Cu2++S2-,当c(H+)增大的情况下,c(S2-)减小的情况下,前者平衡正向移动,即离子积c(Zn2+)×c(S2-)小于Ksp(ZnS),并且离子积c(Cu2+)×c(S2-)大于Ksp(CuS),则Ksp(ZnS)较大
(2)从表格数据可知,在较低pH下Fe3+已经全部沉淀完全,但Fe2+与Zn2+沉淀的pH范围重合,故需要先用氧化剂将Fe2+氧化,再沉淀除去,为不引入杂质同时不能与加入的氨水反应,H2O2最合适:2Fe2++H2O2+2H+=2Fe3++2H2O
(3)由所给数据可知,为保证Fe3+沉淀完全,但Zn2+不能沉淀,可将pH控制在3.2~6.2之间
(4)Fe3++3NH3·H2O ="==" Fe(OH)3↓+3 NH4+
(5)乙溶液中pH最小为6.2,c(OH—)最小为10—6.2mol/L,c(Fe3+)最大为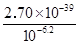 =2.7×10-20.4mol/L
=2.7×10-20.4mol/L
(6)(NH4)2 SO4
(7)由流程中参加反应的物质及生成物可知发生的反应为:2ZnSO4 +NH4HCO3 +3 NH3·H2O="=" Zn2(OH)2CO3 ↓+2(NH4)2 SO4 + H2O
本题难度:一般
4、实验题 (8分)立足教材实验是掌握高中化学实验的基础,是理解化学科学的实验原理、实验方法和实验思路,提高学生实验能力的基本途径。
(1)实验1:取一块金属钠,在玻璃片上用滤纸吸干表面的煤油后,用小刀切去一端的外皮。观察钠的颜色。这个实验中还需用到的一种仪器是?;
(2)实验2:向一个盛有水的小烧杯里滴入几滴酚酞试液,然后把一小块钠投入小烧杯。把反应的现象和相应结论填入空格。“浮”---钠的密度比水小;“熔”--- ?;“红”---反应生成了氢氧化钠;
(3)实验3:在两支试管里分别加入5mL 盐酸和5mL NaOH溶液,在各放入一小段铝片,观察实验现象。试写出铝和NaOH溶液反应的离子方程式:?;
(4)实验4:把水滴入盛有Na2O2固体的试管中,立即用带火星的木条放在试管口,检验生成的气体。向反应后的溶液中加入酚酞试液,可以看到?;
(5)实验5:在玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气。该氧化还原反应的氧化剂是?;
(6)实验6:在试管里注入少量新制备的FeSO4溶液,用胶头滴管吸取NaOH溶液,将滴管尖端插入试管里溶液底部,慢慢挤出NaOH溶液,可以看到开始时析出一种白色的絮状沉淀,并迅速变成灰绿色,最后变成红褐色。发生这种颜色变化的原因是(用化学方程式表示):??。
参考答案:(1)实验1:镊子?(2)实验2:“熔”——钠的熔点低,反应放热
(3)实验3:2Al+2OH-+2H2O=2AlO2-+3H2↑?(4)实验4:溶液先变红后褪色
(5)实验5:水蒸气?(6)实验6:4Fe(OH)2+O2+2H2O=4Fe(OH)3
本题解析:(1)钠是块状固体,应该用镊子夹取金属钠。
(2)钠迅速熔化,说明钠的熔点低,且反应放热。
(3)铝能和氢氧化钠溶液反应生成氢气和偏铝酸钠,方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑。
(4)氢氧化钠溶于水生成氢氧化钠,溶液显碱性,所以溶液变成红色;同时过氧化钠还具有漂白性,因此溶液的红色会逐渐褪去。
(5)高温下铁能和水蒸气反应生成四氧化三铁和氢气,在反应中铁是还原剂,水蒸气是氧化剂。
(6)氢氧化亚铁具有还原性,极易被氧化生成氢氧化铁,方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。
本题难度:一般
5、实验题 (8分)铁在冷的浓硫酸中能发生钝化。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。请你协助他们探究所得气体的成分。
【提出猜想】
猜想一:所得气体中可能是SO2。
猜想二:所得气体中可能是??。
猜想三:所得气体中可能是??的混合气体。
【实验探究】
(1)将所得气体通入如下装置
?
证明猜想三正确的实验现象?;
(2)点燃试管中的气体前,必须要进行的操作是?。
参考答案:(8分)猜想二:所得气体中可能是H2(1分)
猜想三:所得气体中可能是SO2和H2的混合气体(2分)
(1)甲中KMnO4溶液褪色,乙中KMnO4溶液颜色不变,试管中收集到气体(3分)
(2)验纯(2分)
本题解析:略
本题难度:一般