微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 除去SiO2中的少量Fe2O3,可以用
A.盐酸
B.氢氧化钠溶液
C.氧化钙
D.碳
参考答案:A
本题解析:正确答案:A,SiO2不与HCl反应,Fe2O3+6HCl=2FeCl3+3H2O。
本题难度:简单
2、实验题 (16分)碳和碳的化合物在生产生活实际中应用广泛。运用化学反应原理研究碳的氧化物的性质具有重要意义。
(1)常温下,碳酸在水中的电离常数Ka1=4.2×10-7,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka = 4.7×10-8。写出向“84消毒液”(主要成分为氯化钠和次氯酸钠)中通入二氧化碳发生反应的离子方程式?;
4.7×10-8。写出向“84消毒液”(主要成分为氯化钠和次氯酸钠)中通入二氧化碳发生反应的离子方程式?;
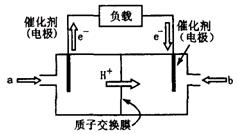
(2)上图为常用笔记本电脑所用的甲醇质子交换膜燃料电池的结构示 意图。电池总反应为2CH3OH+3O2
意图。电池总反应为2CH3OH+3O2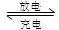 2CO2+4H2O。该装置放电时?(填“a”或“b”)为电池的负极,其电极反应式为?;
2CO2+4H2O。该装置放电时?(填“a”或“b”)为电池的负极,其电极反应式为?;
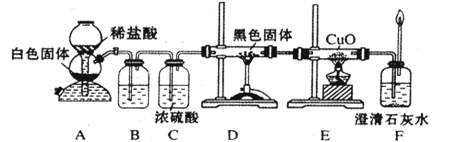
(3)CO具有还原性,某化学研究小组为证明CO具有还原性,设计了如图所示的实验装置。
已知:C + H2O CO+H2? CO + H2O
CO+H2? CO + H2O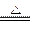 ?CO2 +
?CO2 +  H2? C + CO2
H2? C + CO2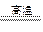 2CO
2CO
试回答下列问题:
①装置B中最适宜的试剂是?,必须用装置C吸收气体中的水蒸气的理由是?;
②根据该实验中的?现象,可证明CO具有还原性;
③若要根据装置F中石灰水变浑浊的现象准确确认CO具有还原性,则应在上图装置?与?之间(填字母标号)连接下图中的?装置(选填序号)。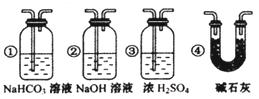
参考答案:(16分)
(1)ClO-+ CO2 + H2O ="==?" HClO + HCO3-(2分)
(2)a (2分)CH3OH + H2O → CO2↑ +6H+ + 6e-(2分)
(3)①饱和NaHCO3溶液(2分)?防止水蒸气与炭反应生成的氢气对实验现象产生干扰(2分)
②E装置中黑色CuO变成红色(2分)
③D、E(2分)④(2分)
本题解析:略
本题难度:一般
3、选择题 将足量CO2通入KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(y)的关系正确的是
[? ]
A. 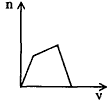
B.?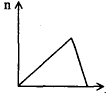
C. 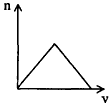
D. 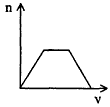
参考答案:D
本题解析:
本题难度:一般
4、计算题 将一含SiO2杂质的石灰石样品100g加强热反应后,质量变为60.4 g。试计算:
(1)生成是气体在标准状况下的体积。
(2)该石灰石的纯度(碳酸钙的质量分数)。
参考答案:(1)20.16L。(2)90%
本题解析:(1)根据质量守恒定律,m(CO2)=100g-60.4 g=39.6 g,n(CO2)=39.6 g÷44g/mol=0.9mol,v(CO2)=0.9mol×22.4L/mol=20.16L。
(2)n(CaCO3)=n(CO2)=0.9mol,m(CaCO3)=0.9mol×100g/mol=90g,其质量分数为90%。
本题难度:简单
5、选择题 往含有0.2 mol NaOH和0.1 mol Ba(OH)2溶液中持续稳定地通入CO2气体,当通入气体为8.96 L(标准状况下)时立即停止。则这一过程中,溶液中离子的物质的量和通入CO2气体的体积关系正确的图象是(气体的溶解和离子的水解忽略不计)(?)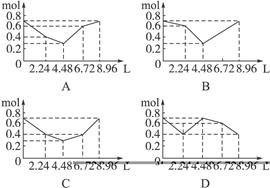
参考答案:C
本题解析:
本题涉及的化学反应为:Ba(OH)2+CO2====BaCO3↓+H2O? ①
2NaOH+CO2====Na2CO3+H2O? ②
BaCO3+CO2+H2O====Ba(HCO3)2?③
Na2CO3+CO2+H2O====2NaHCO3? ④
当未通入CO2气体时,溶液中离子分别为0.2 mol Na+、0.1 mol Ba2+、0.4 mol OH-;当通入2.24 L CO2气体时,发生反应①,此时溶液中离子分别为0.2 mol Na+ 0.2 mol OH-;当通入4.48 L CO2时,发生反应②,此时溶液中离子分别为0.2 mol Na+、0.1 mol 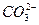 ;当通入6.72 L CO2时,发生反应④,此时溶液中离子分别为0.2 mol Na+、0.2 mol
;当通入6.72 L CO2时,发生反应④,此时溶液中离子分别为0.2 mol Na+、0.2 mol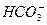 ;当通入8.96 L CO2时,发生反应③,此时溶液中离子分别为0.2 mol Na+、0.1 mol Ba2+、0.4 mol
;当通入8.96 L CO2时,发生反应③,此时溶液中离子分别为0.2 mol Na+、0.1 mol Ba2+、0.4 mol 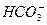 ,共0.7 mol。对比图象可知C项正确。
,共0.7 mol。对比图象可知C项正确。
本题难度:简单