微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 为了证明一氧化碳具有还原性,有人设计了下列实验:

(1)装置B中最适宜的试剂是?。
(2)装置D中发生反应的化学方程式是?,?。
(3)必须用装置C吸收除去气体中水蒸气的理由是?,?。
(4)若根据F中石灰水变浑浊的现象也能确定CO具有还原性,应在上图中装置?与?之间连接下列装置中的?(填序号)。
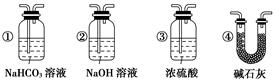
参考答案:(1)饱和NaHCO3溶液
(2)CO2+C 2CO
2CO
(3)水蒸气进入D中在高温下能跟碳反应产生H2,H2也能使CuO还原,不能证明CO具有还原性
(4)D E ④
本题解析:解答本题注意以下两点:(1)该实验的原理,先制取纯净、干燥的CO2,再用C将CO2还原为CO,利用CO的还原性来检验CO的存在。(2)注意排除水蒸气对实验的干扰。
本题难度:一般
2、填空题 氮化硅是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定,工业上曾普遍采用高纯硅与纯氮在1 300 ℃反应获得。
(1)写出N原子结构示意图:_______,根据元素周期律知识,请写出氮化硅的化学式:_______。
(2)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其他无机酸反应。试推测该陶瓷被氢氟酸腐蚀的化学方程式:______________。
(3)现用四氯化硅和氮气在氢气气氛保护下,加强热发生反应,可得较高纯度的氮化硅,反应的化学方程式为______________。
参考答案:
(1) 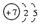 ?Si3N4
?Si3N4
(2)Si3N4+12HF 3SiF4↑+4NH3↑
3SiF4↑+4NH3↑
(3)3SiCl4+2N2+6H2 Si3N4+12HCl
Si3N4+12HCl
本题解析:(1)根据Si元素最高为+4价,氮元素负化合价为-3,化合物中化合价代数和为0,故氮化硅化学式为Si3N4。
(2)根据硅元素的特性之一:与F元素组合成SiF4。
(3)依据质量守恒及-1价氯的稳定性。
本题难度:简单
3、选择题 某些含结晶水的铝硅酸盐失水后成为多孔的晶体,这些孔穴能让气体和液体中直径比孔道小的分子通过,而将大分子留在外面,起着“筛分”的作用,因此有“分子筛”之称,某沸石分子筛,其主要成分为Na2H8AlxSi2O12,它可以用氧化物形式来表示,其中正确的是(?)
A.2Na2O·Al2O3·4SiO2·4H2O
B.Na2O·Al2O3·2SiO2·4H2O
C.Na2O·Al2O3·SiO2·H2O
D.2Na2O·Al2O3·2SiO2·4H2O
参考答案:B
本题解析:根据正负化合价的代数和为零,可得x=2,故改写成氧化物的形式应为Na2O·Al2O3·2SiO2·4H2O。
本题难度:简单
4、选择题 已知硅能与强碱溶液反应放出氢气,同时生成硅酸钠。现有一种粗铝含铁、硅两杂质,取等质量的样品,分别投入足量的稀盐酸和氢氧化钠溶液中,充分反应后都放出等量的氢气,则粗铝中铁和硅的物质的量比为( )
A.1∶1
B.2∶1
C.1∶2
D.3∶1
参考答案:B
本题解析:本题考查Al、Fe、Si的化学性质,明确发生的化学反应及信息中生成氢气的量相同是解答本题的关键,先根据发生的反应写出对应的反应化学方程式
2Al+6HCl═2AlCl3+3H2↑、Fe+2HCl═FeCl2+H2↑、Si+2NaOH+H2O═Na2SiO3+2H2↑,
2Al+2NaOH+2H2O═2NaAlO2+3H2↑,酸、碱足量,则在与酸的反应中Fe、Al完全反应,在与碱的反应中,Al、Si完全反应,再利用放出等量的氢气来计算。由应2Al+6HCl═2AlCl3+3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑,说明由Al产生的氢气是一样多的,则等质量的样品分别投入足量的稀盐酸和氢氧化钠溶液中,充分反应后都放出等量的氢气,则反应Fe+2HCl═FeCl2+H2↑、Si+2NaOH+H2O═Na2SiO3+2H2↑中生成的氢气相同,若都生成1molH2,需要的n(Fe)=1mol,n(Si)=0.5mol,则粗铝中铁和硅的物质的量比为2mol:1mol=2:1,故选B.
本题难度:一般
5、选择题 下列叙述正确的是( )。
A.高温下二氧化硅与碳酸钠反应放出二氧化碳,说明硅酸(H2SiO3)的酸性比碳酸强
B.陶瓷、玻璃、水泥容器都能贮存氢氟酸
C.石灰抹墙、水泥砌墙的硬化过程原理相同
D.玻璃窑中出来的气体的主要成分是二氧化碳
参考答案:D
本题解析:二氧化硅在高温下能与碳酸钠反应:Na2CO3+SiO2 Na2SiO3+CO2↑,但不能说明硅酸的酸性比碳酸强,上述反应之所以能进行,是因为CO2不断逸出,而促使了反应向右进行;玻璃、陶瓷、水泥中均含有SiO2,会与氢氟酸反应;石灰抺墙的硬化过程是因为发生了反应CO2+Ca(OH)2=CaCO3+H2O,而水泥砌墙是水泥与水作用发生一系列变化而凝固变硬。
Na2SiO3+CO2↑,但不能说明硅酸的酸性比碳酸强,上述反应之所以能进行,是因为CO2不断逸出,而促使了反应向右进行;玻璃、陶瓷、水泥中均含有SiO2,会与氢氟酸反应;石灰抺墙的硬化过程是因为发生了反应CO2+Ca(OH)2=CaCO3+H2O,而水泥砌墙是水泥与水作用发生一系列变化而凝固变硬。
本题难度:一般