微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法可以实现的是
[? ]
①酸性氧化物均能与碱发生反应
②弱酸溶液与强酸盐溶液反应可以生成强酸
③发生复分解反应,但产物既没有水生成,也没有沉淀和气体生成
④两种酸溶液充分反应后,所得溶液呈中性
⑤有单质参加反应,但该反应不是氧化还原反应
A.②③④
B.②③⑤
C.①②④
D.①②③④⑤
参考答案:D
本题解析:
本题难度:一般
2、选择题 氢化钙中的氢元素为-1价,它可用作生氢剂,反应的化学方程式是:
CaH2+2H2O=Ca(OH)2+2H2↑ ,有下列判断:①H2只是氧化产物;②H2只是还原产物;③H2O是氧化剂④CaH2中的氢元素被还原;⑤此反应中氧化产物与还原产物的原子个数之比为1:1,上述判断中正确的是
A.①②③
B.③⑤
C.②④
D.④⑤
参考答案:B
本题解析:氢化钙中H为-1价,反应中元素化合价变化为:
H:-1→0?失1×2e-
H:+1→0?得1×2e-
反应中氢化钙是还原剂,水是氧化剂,H2既是氧化产物又是还原产物,氧化产物与还原产物物质的量比为1:1。
点评:氧化还原反应中,同种元素化合价变化遵循“只靠拢、不交叉”的原则。
本题难度:一般
3、选择题 稀土元素是宝贵的战略资源.我国的蕴藏量居世界首位。铈(Ce)是地壳中含量最高的稀土元素.在稀土混合溶液中加人H2O2,调节 转变为
转变为 沉淀得以分离。其反应的化学方程式可表示为
沉淀得以分离。其反应的化学方程式可表示为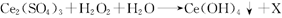 (未配平)。下列对该反应的说法不正确的是
(未配平)。下列对该反应的说法不正确的是
A.X为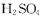
B.H2O2为氧化剂
C.该反应属于非氧化还原反应
D.该反应中每生成52g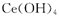 ,转移电子的物质的量为0. 25 mol
,转移电子的物质的量为0. 25 mol
参考答案:C
本题解析:A正确,根据质量守恒定律得X为H2SO4;B正确,在反应中过氧化氢中O元素的化合价降低,为氧化剂;C错,由于在反应中出现了元素的化合价升降,所以该反应为氧化还原反应;D正确,根据氧化还原反应中得失电子数相等可得,每生成52g ,转移电子的物质的量为0. 25 mol
,转移电子的物质的量为0. 25 mol
本题难度:一般
4、填空题 (3分)(1)我国政府规定食用盐中必须加入一定量的KIO3(碘酸钾),其中碘元素的化合价为 价。
(2)海水中镁的总储量约为2×1015 t,目前世界上生产的镁有60%来自海水,海水中的镁元素处于 (填“游离态”或“化合态”),从海水中提取氯化镁 (填 “属于”或“不属于”)氧化还原反应。
参考答案:(1)、? +5?(2)、化合态? ,?不属于
本题解析:(1)已知K是+1价,O是-2价,依据化合物中化合价代数和为零,可得I的化合价为+5价;(2)金属镁性质较活泼,所以在自然界中以化合态形式存在,从镁的化合物中提炼镁单质,发生了化合价的变化,所以属于氧化还原反应。
点评:依据化合物中化合价代数和为零计算化合价,熟悉镁的性质和制备原理
本题难度:一般
5、选择题 下列反应中,属于有水参加的氧化还原反应,且水只作氧化剂的是(?)
A.SO2+H2O====H2SO3
B.Cl2+H2O====HCl+HClO
C.2H2O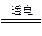 2H2↑+O2↑
2H2↑+O2↑
D.3Fe+4H2O(g)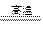 Fe3O4+4H2↑
Fe3O4+4H2↑
参考答案:D
本题解析:A项属非氧化还原反应;B项属氧化还原反应,但水既不作氧化剂也不作还原剂;C项水既作氧化剂又作还原剂;D项水作氧化剂,铁作还原剂,故选D。
本题难度:简单