微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 由金红石(TiO2)制取单质Ti,涉及到的部分步骤为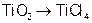
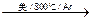 Ti
Ti
已知:① ? ?
? ? ?②
?②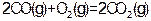 ?
?
③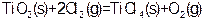 ?
?
则反应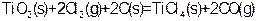 的
的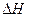 为
为
A. +2
+2 -2
-2
B. +2
+2 +
+
C. +2
+2 -
-
D. +2
+2 -2
-2
参考答案:C
本题解析:略
本题难度:一般
2、填空题 (共12分)
(1)以CO2为碳源制取低碳有机物一直是化学领域的研究热点,CO2加氢制取低碳醇的反应如下:
反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=-49.0kJ/mol
反应II:2CO2(g)+6H2(g)=CH3CH2OH(g)+3H2O(g) △H=-173.6kJ/mol
写出由CH3OH(g)合成CH3CH2OH(g)的反应的热化学方程式_______________
(2)高铁酸钾(K2FeO4)是铁的一种重要化合物,具有极强的氧化性
①电解法是工业上制备K2FeO4的一种方法。以铁为阳极电解氢氧化钠溶液,然后在阳极溶液中加入KOH。电解时阳极发生反应生成FeO42-,该电极反应式为_________________
②与MnO2—Zn电池类似,K2FeO4—Zn也可以组成碱性电池,K2FeO4在电池中作正极材料,其电极反应式为FeO42-+3e-+4H2O=Fe(OH)3+5OH-,则该电池总反应的离子方程式为__________________
(3)amol FeS与bmol FeO投入到VL、C mol/L的硝酸溶液中充分反应产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为_____
①(a+b)×63g?②(a+b)×189g?③(a+b)mol?④VC-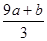 mol
mol
参考答案:(1)2CH3OH(g)=CH3CH2OH(g)+H2O(g) △H= -75.6kJ/mol
(2)①Fe-6e- +8OH- = FeO42- + 4H2O
②3Zn + 2FeO42- + 8H2O = 2Fe(OH)3 + 3Zn(OH)2 + 4OH-
(3)②④
本题解析:(1)盖斯定律:不管化学反应是一步完成或分几步完成,其反应热相同。故有
2CH3OH(g)+2H2O(g) =2CO2(g)+6H2(g)?△H=-98.0kJ/mol?①
2CO2(g)+6H2(g)=CH3CH2OH(g)+3H2O(g) △H=-173.6kJ/mol?②
①+②得2CH3OH(g)=CH3CH2OH(g)+H2O(g) △H= -75.6kJ/mol
(2)电解池中,电池正极连接的电极叫做阳极,发生氧化反应,负极连接的电极叫做阴极,发生还原反应。
①此题以铁为阳极,电解氢氧化钠溶液,生成FeO42-,故电极方程式为
Fe-6e- +8OH- = FeO42- + 4H2O
②在K2FeO4—Zn碱性电池中,正极得电子被还原,其电极反应式为
FeO42-+3e-+4H2O=Fe(OH)3+5OH-,负极Zn被氧化,
其电极反应式为:Zn-2e-+2OH-=Zn(OH)2,将两极得失电子数守恒后合并可得总反应式:2FeO42-+8H2O+3Zn=2Fe(OH)3+3Zn(OH)2+4OH-。
(3)反应中硝酸有两个作用,一是做氧化剂被还原成NO气体。二是起酸的作用生成硝酸铁,这一部分硝酸根化合价没变化,没有被还原。所以根据反应前亚铁离子总量即可知道反应后硝酸铁总量,进一步就知道了没被还原的硝酸的量。反应前有a mol FeS与b mol FeO ,根据铁原子守恒知道反应后Fe(NO3)3的物质的量是(a+b)mol,那么里面硝酸根的物质的量是3(a+b)mol,即有3(a+b)mol硝酸没有被还原,其质量是
 ,②正确。
,②正确。
另外可以从得失电子角度考虑。
FeS被氧化为硝酸铁和硫酸,铁升高1价,硫升高8价,所以a mol FeS反应中失去电子9amol。FeO被氧化为硝酸铁,铁升高1价,所以b mol FeO 反应中失去电子bmol。
失去的电子被硝酸根得到,硝酸根还原成NO,氮元素化合价降低3价,根据得失电子守恒知道,被还原的硝酸的物质的量是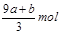 mol又因为硝酸总量是n==CVmol,所以未被还原的硝酸的物质的量是
mol又因为硝酸总量是n==CVmol,所以未被还原的硝酸的物质的量是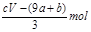 ,④答案正确。
,④答案正确。
点评:本题考出学生对盖斯定律的理解掌握,在答题过程中要注意符号的书写以及有效数字
的保留问题;电解池原理,要求学生掌握相关的电极方程式和总的方程式;第三小题,需要
学生理解硝酸在反应中的应用。
本题难度:一般
3、选择题 某学生用如图所示装置进行化学反应X+2Y===2Z能量变化情况的研究。当往试管中滴加试剂Y时,看到导管中甲处液面下降,乙处液面上升。关于该反应的叙述正确的是( )

①该反应为放热反应 ?②生成物的总能量比反应物的总能量高 ③该反应过程可以看成是“贮存”于X、Y内部的能量转化为热量而释放出来
A.①②③
B.①③
C.①②
D.②
参考答案:B
本题解析:导管中甲处液面下降,乙处液面上升,说明容器内温度升高,反应放热,故选项B正确。
本题难度:简单
4、选择题 有如下三个反应方程式?
H2(g)+1/2O2(g)=H2O(g);△H= a kJ/mol
H2(g)+1/2O2(g)=H2O(l);△H= b kJ/mol
2H2(g)+O2(g)=2H2O(l);△H= c kJ/mol
关于它们的下列叙述正确的是(?)
A.a < b
B.a、b、c均为正值
C.2b=c
D.它们都是吸热反应
参考答案:C
本题解析:氢气燃烧是放热反应,△H<0。由于气态水的能量高于液态水的能量,所以生成液态水放热多,但放热越多,△H越小,所以答案选C。
点评:在比较反应热的大小时,由于△H是带有正负号的,所以在比较时应该带着符号进行比较。即对于放热反应来讲,放热越多,△H越小。
本题难度:一般
5、填空题 同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成还是分几步完成,这个总过程的热效应是相同的”观点来计算反应热。已知:
P4(s,白磷)+5O2(g)====P4O10(s)
ΔH="-2" 983.2 kJ·mol-1①
P(s,红磷)+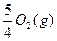 ====
====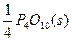 ?
?
ΔH="-738.5" kJ·mol-1②
则白磷转化为红磷的热化学方程式为_________。相同状况下,能量状态较低的是_________;白磷的稳定性比红磷_________(填“高”或“低”)。
参考答案:P4(s,白磷)====4P(s,红磷)
ΔH="-29.2" kJ·mol-1?红磷?低
本题解析:①-4×②得P4(s,白磷)=4P(s,红磷)? ΔH=ΔH1-4ΔH2="-2" 983.2 kJ·mol-1-4×(-738.5 kJ·mol-1)="-29.2" kJ·mol-1,即P4(s,白磷)====4P(s,红磷)? ΔH="-29.2" kJ·mol-1。白磷转化为红磷是放热反应,稳定性比红磷低(能量越低越稳定)。
本题难度:简单