微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组中的离子,能在溶液中大量共存的是(?)
A.Mg2+、SO42―、K+、Cl―
B.CO32―、Na+、Ca2+、NO3―
C.Al3+、CO32―、OH―、CH3COO―
D.NO3―、Ag+、H+、Cl―
参考答案:A
本题解析:B中CO32―和Ca2+产生沉淀,C中Al3+和CO32―发生双水解,D中Ag+和Cl―产生沉淀。答案选A。
点评:离子不能大量共存的一般情况是:(1)能发生复分解反应的离子之间(即生成沉淀,气体,水、弱酸、弱碱等难电离物质);(2)能生成难溶物的离子之间(如:Ca2+和 SO42-;Ag+和 SO42-);(3)能完全水解的离子之间,如多元弱酸和弱碱盐的阴、阳离子(如:Al3+, Fe3+与 CO32-、HCO3-、AlO2-等);(4)能发生氧化还原反应的离子之间(如:Fe 、H+、NO3-;S2-、ClO-;S2-、 Fe3+等);(5)能发生络合反应的离子之间(如 Fe3+和 SCN-);解决离子共存问题时还应该注意题目所隐含的条件,题目所隐含的条件一般有:(1)溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;(2)溶液的颜色,如无色时可排除 Cu2+、 Fe2+、Fe3+、MnO4-等有色离子的存在;(3)溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;(4)是“可能”共存,还是“一定”共存等。
本题难度:一般
2、选择题 100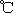 时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则混合前,a与b之间应满足的关系是
时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则混合前,a与b之间应满足的关系是
参考答案:C
本题解析:混合呈中性,故有氢离子浓度等于氢氧根离子浓度。100×10-a=1×10-(12-b)(100℃,PKw=12);故有a+b=14
本题难度:简单
3、填空题 有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、 、
、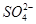 、Cl-、I-、
、Cl-、I-、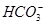 ,取该溶液进行如下实验:
,取该溶液进行如下实验:
实验步骤
| 实验现象
|
①取少量该溶液,加几滴甲基橙溶液
| 溶液变红色
|
②取少量该溶液,加入铜片和浓硫酸,加热
| 有无色气体产生,遇空气可以变成红棕色
|
③取少量该溶液,加入BaCl2溶液
| 有白色沉淀生成
|
④取③中的上层清液,加入AgNO3溶液
| 有稳定的白色沉淀生成,且不溶于稀硝酸
|
⑤取少量该溶液,加入NaOH溶液
| 有白色沉淀生成,当NaOH过量时,沉淀部分溶解
|
由此判断:
(1)溶液中一定存在的离子是?;溶液中肯定不存在的离子是?。
(2)为进一步确定其他离子,应该补充的实验及对应欲检验离子的名称(若为溶液反应,说明使用试剂的名称,不必写详细步骤)?。
(3)写出实验⑤中所有反应的离子方程式:?。
参考答案:(1) 、
、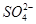 、Mg2+、Al3+Fe2+、
、Mg2+、Al3+Fe2+、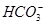 、I-、Ba2+
、I-、Ba2+
(2)K+的检验可以用焰色反应;Cl-的检验:向溶液中加足量的硝酸钡溶液,过滤后,向滤液中加硝酸银溶液,再加稀硝酸,若生成白色沉淀不溶解,则证明有Cl-
(3)H++OH-=H2O Mg2++2OH-=Mg(OH)2↓ Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=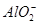 +2H2O
+2H2O
本题解析:原溶液无色,则其中不含有Fe2+;实验①说明溶液呈酸性,所以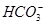 不能大量存在;实验②说明溶液中含有
不能大量存在;实验②说明溶液中含有 ,因为I-能被HNO3氧化,所以I-不能大量存在;实验③说明原溶液中含有
,因为I-能被HNO3氧化,所以I-不能大量存在;实验③说明原溶液中含有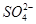 ,则肯定不含Ba2+;实验④无法说明原溶液中是否含有Cl-,因为实验③引入了Cl-;实验⑤说明溶液中含有Mg2+和Al3+。
,则肯定不含Ba2+;实验④无法说明原溶液中是否含有Cl-,因为实验③引入了Cl-;实验⑤说明溶液中含有Mg2+和Al3+。
本题难度:一般
4、选择题 运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g) 2NH3(g),在恒温、恒压条件下向平衡体系中通入氩气,平衡?移动(填“向左”、“向右”或“不”);使用催化剂使反应的△H?(填“增大”、“减小”或“不改变”)。
2NH3(g),在恒温、恒压条件下向平衡体系中通入氩气,平衡?移动(填“向左”、“向右”或“不”);使用催化剂使反应的△H?(填“增大”、“减小”或“不改变”)。
(2)在25℃下,向浓度均 为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,沉淀会分步析出。
为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,沉淀会分步析出。
首先生成沉淀的离子方程式为? __________________??
氨水过量后,生成的沉淀会部分溶解,写出溶解沉淀的离子方程式__________________________.
(?已知25℃时Ksp[Mg(OH)2]=1.8×10-11,? KsP[Cu(OH)2]=2.2×10- 20?)
20?)
(3)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应后溶液中
c(NH4+) = c(Cl-)。则溶液显? _____?性(填“酸”、“碱”或“中”),请用含a的代数式表示NH3·H2O的电离常数Kb=?。
(4) 在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0.10molO2,半分钟后达到平衡,测得容器中含SO3?0.18mol,则v(o2)=?mol.L-1.min-1:若继续通入0.20mol SO2和0.10mol O2,再次达到平衡后, n(SO3)的取值范围为________________。
参考答案: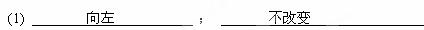

(a-0.01)_______________________?。
(4)? _0.036___? ___ ?: _______0.40>n(SO3)> 0.36__________________。
本题解析:略
本题难度:一般
5、选择题 下列离子组一定能大量共存的是( )
A.Na+ 、I-、NO3-、ClO-
B.Na+、0H- 、NO3-、HCO3-
C.H+、Fe2+、NO3-、Cl-
D.[Al(OH)4]-、SO42-、0H-、Na+