微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 X、Y、Z、W均为中学化学中常见物质,一定条件下它们之间有如下转化关系(其它产物已略去):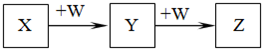
下列说法不正确的是
A.若W是强氧化性的单质,则X可能是金属铝
B.若W是氢氧化钠,则X水溶液为酸性
C.若W是单质铁,则Z溶液可能是FeCl2溶液
D.若W是氧气,则X、Z的相对分子质量可能相差14
参考答案:A
本题解析:分析:A.根据W具有强氧化性去逐步分析;
B.根据题意推知氢氧化物Y具有酸性,从而推知其他物质;
C.根据假设去验证各个反应;
D.根据W是氧气,推测X可能为什么物质,进而得出其他物质.
解答:A.若 W是强氧化性的单质,则Y与Z中的元素应具有可变化合价,X肯定不会是铝,故A错误;
B.若W是氢氧化钠,说明X能连续与氢氧化钠反应,即Y应是氢氧化物,Y能与氢氧化钠继续反应,说明氢氧化物Y具有酸性,则Y必是氢氧化铝,则X必是含有Al3+的溶液,Al3+水解使溶液呈酸性.故B正确;
C.如果W是Fe,Z是FeCl2,则Y必是FeCl3,发生的化学反应是2FeCl2+Cl2═2FeCl3,则X是盐酸,符合题干要求,故C正确;
D.若W是氧气,则X应是能被氧气连续氧化的物质,即一般情况Y和Z都是氧化物,如X可以是碳,Y是CO,Z是CO2.若果X是C2H6,则Y是CO,Z是CO2.即C2H6和CO2的相对原子质量相差14,故D正确;
故选A.
点评:本题根据一个反应线索,去进行各种可能性的设问,考查了学生对元素及其化合物知识的掌握程度,具有较大的难度,解答这类题目的关键在于学生要掌握系统的相关知识.
本题难度:简单
2、填空题 铝是最常见的金属之一。
(1)浓硝酸、浓硫酸可贮存在铝制容器的原因是?。
(2)纳米铝主要应用于火箭推进剂。工业上利用无水氯化铝与氢化铝锂(LiAlH4)在有机溶剂中反应制得纳米铝,化学方程式如下:3LiAlH4+AlCl3="4Al" + 3LiCl + 6H2↑
该反应的氧化剂为?。
(3)氢化铝钠(NaAlH4)是一种重要的储氢材料,已知:
NaAlH4(s)=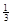 Na3AlH6 (s)+
Na3AlH6 (s)+ 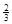 Al (s) + H2(g)?ΔH=+ 37 kJ·molˉ1
Al (s) + H2(g)?ΔH=+ 37 kJ·molˉ1
Na3AlH6(s)="3NaH(s)+" Al (s) + 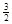 H2(g)?ΔH=+ 70.5 kJ·molˉ1
H2(g)?ΔH=+ 70.5 kJ·molˉ1
则NaAlH4(s)=" NaH(s)" + Al (s) +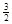 H2(g)?ΔH=?。
H2(g)?ΔH=?。

(4)已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式 存在。目前研究比较热门的Al-H2O2燃料电池,其原理如右图所示,电池总反应如下:
2Al+3HO2-+3H2O =2[Al(OH) 4]-+OH-
①正极反应式为?。
②与普通锌锰干电池相比,当消耗相同质量的负极活性物质时,Al-H2O2燃料电池的理论放电量约为普通锌锰干电池的______倍。
③Al电极易被NaOH溶液化学腐蚀,这是该电池目前未能推广使用的原因之一。反应的离子方程式为?。
参考答案:(9分)(1)常温下,铝易被浓硝酸、浓硫酸钝化
(2)LiAlH4、AlCl3?(3)+ 60.5 kJ·molˉ1
(4)① 3HO2-+3H2O+6e-=9OH-(或HO2-+H2O+2e-=3OH-)?
② 3.6 (2分)?③ 2Al+6H2O+2OH-=2[Al(OH) 4]-+3H2↑
本题解析:(1)常温下,铝易被浓硝酸、浓硫酸钝化,所以浓硝酸、浓硫酸可贮存在铝制容器中。
(2)根据反应的方程式可知,铝元素的化合价从+3价降低到0价,得到电子,发生还原反应,所以氧化剂是LiAlH4、AlCl3 。
(3)根据盖斯定律可知,①+②×1/3,即得到反应式NaAlH4(s)=" NaH(s)" + Al (s) + H2(g),所以该反应的△H=+37 kJ/mol+70.5 kJ/mol÷3=+60.5 kJ/mol.
H2(g),所以该反应的△H=+37 kJ/mol+70.5 kJ/mol÷3=+60.5 kJ/mol.
(4)①原电池中正极得到电子,则根据总的反应式可知Al失去电子,做负极,所以正极反应式是3HO2-+3H2O+6e-=9OH-(或HO2-+H2O+2e-=3OH-)。
②普通锌锰干电池中负极是锌,65g锌失去2mol电子,而65g铝失去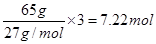 电子,所以Al-H2O2燃料电池的理论放电量约为普通锌锰干电池的7.22÷2=3.6倍。
电子,所以Al-H2O2燃料电池的理论放电量约为普通锌锰干电池的7.22÷2=3.6倍。
③铝能和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式是2Al+6H2O+2OH-=2[Al(OH) 4]-+3H2↑。
点评:该题是中等难度的试题,试题设计新颖,基础性强,有利于调动学生的学习兴趣和学习积极性,激发学生的学习求知欲,也有利于培养学生的规范答题能力和逻辑推理能力,提高学生的学习效率。
本题难度:困难
3、选择题 铝元素是金属元素,某同学认为铝也有一定的非金属性。下列描述中,你认为能支持该同学观点的是
A.铝片能与盐酸反应生成氢气
B.氢氧化铝能溶于强碱溶液
C.氯化铝溶液显酸性
D.铝能发生铝热反应
参考答案:B
本题解析:略
本题难度:简单
4、选择题 下列物质组合中,既能和酸反应又能和碱反应的化合物是( )
①Al?②Al2O3?③Al(OH)3?④NaHCO3.
A.①②③④
B.②③④
C.①③④
D.①②④
参考答案:①为单质,不符合题意,故①错误;
②为两性氧化物,与酸反应:Al2O3+6HCl=2AlCl3+3H2O,也能与碱反应:Al2O3+2NaOH=2NaAlO2+H2O,故②正确;
③为两性氢氧化物,与酸反应:Al(OH)3+3HCl=AlCl3+3H2O,也能与碱反应:Al(OH)3+NaOH=NaAlO2+2H2O,故③正确;
④为弱酸的酸式盐,与酸反应:NaHCO3+HCl=NaCl+H2O+CO2↑,也能与碱反应:NaHCO3+NaOH=Na2CO3+H2O,故④正确.
故选B.
本题解析:
本题难度:一般
5、选择题 将足量的铝粉分别投入等物质的量浓度的NaOH溶液和盐酸中,待反应结束后,两者产生的气体在相同状况下占有相同的体积。下列叙述不正确的是
A.消耗铝的质量相等
B.NaOH溶液和盐酸的体积相等
C.两反应中转移的电子数相等
D.反应中生成的NaAlO2和AlCl3物质的量相等
参考答案:B
本题解析:略
本题难度:简单