微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 氨是重要的化工产品和化工原料。
(1)氨的电子式是 。
(2)已知:
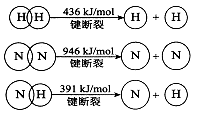
①合成氨的热化学方程式是 。
②降低温度,该反应的化学平衡常数K .(填“增大”、“减小’’或“不变”)。
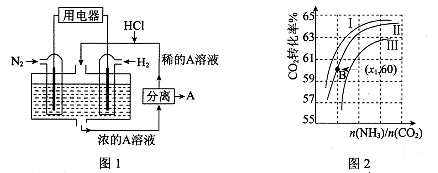
(3)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图l所示。
电池正极的电极反应式是 ,A是 。
(4)用氨合成尿素的反应为2NH3(g)+CO2(g) CO(NH2)2(l)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比
CO(NH2)2(l)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比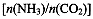 、水碳比
、水碳比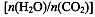 的变化关系。
的变化关系。
①曲线I、II、III对应的水碳比最大的是 。
②测得B点氨的转化率为40%,则x1 。
参考答案:(13分)
(1)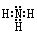 (2分)
(2分)
(2)①N2(g)+3H2(g)=2NH3(g) △H=-92kJ/mol
②增大
(3)N2+8H++6e-=2NH4+ (2分) NH4Cl (2分)
(4)Ⅲ (1分); 3 (2分)
本题解析:(1)氨的分子中氮与氢原子之间形成一对共用电子对,所以氨的电子式是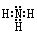
(2)①根据反应的△H=反应物的总键能-生成物的总键能,计算合成氨的△H=946kJ/mol+3×436kJ/mol-3×391×2kJ/mol=-92kJ/mol,所以合成氨的热化学方程式是N2(g)+3H2(g)=2NH3(g) △H=-92kJ/mol;
②该反应放热,所以降温,平衡正向移动,生成物浓度增大,反应物浓度减小,化学平衡常数将增大;
(3)该电池的本质反应是合成氨反应,所以正极是氮气发生还原反应,电极反应式为N2+8H++6e-=2NH4+;生成的铵根离子与氯化氢结合生成氯化铵,所以A是NH4Cl;
(4)氨碳比一定时,水碳比越大,说明原料气中含二氧化碳越少,二氧化碳的转化率越低,所以二氧化碳转化率最低的即为水碳比最大的,是Ⅲ曲线;B点二氧化碳的转化率是60%,氨气的转化率是40%,设NH3、CO2的起始物质的量分别为n1、n2,则n1×40%/2= n2×60%,解得n1/n2= x1=3。
考点:考查电子式、热化学方程式、电极反应式的书写,平衡移动的判断,化学平衡常数的判断,对图像的分析能力
本题难度:困难
2、选择题 某原电池总反应的离子方程式为Zn+Cu2+═Zn2++Cu,该原电池的正确组成是( )
| 正极 | 负极 | 电解质溶液
A
Cu
Zn
ZnCl2
B
Cu
Zn
CuCl2
C
Zn
Cu
ZnCl2
D
Zn
Cu
CuCl2
|
A.A
B.B
C.C
D.D
参考答案:由电池反应式Zn+Cu2+═Zn2++Cu知,锌失电子发生氧化反应,失电子的物质的负极上发生氧化反应,所以锌作负极;不如锌活泼的金属或导电的非金属作正极,可用铜作正极;正极上铜离子得电子发生还原反应,所以电解质溶液中应含有铜离子,可用含有铜离子的盐溶液作电解质溶液,故选B.
本题解析:
本题难度:一般
3、选择题 已知蓄电池在放电时起原电池的作用,充电时起电解池的作用。铅蓄电池在放电和充
电时发生的化学反应可用下式表示:Pb+PbO2+2H2SO4 2PbSO4+2H2O据此判断下列叙述
2PbSO4+2H2O据此判断下列叙述
正确的是
A.放电时负极电极反应式为:PbO2+4H+ + SO42-+2e- PbSO4+2H2O
PbSO4+2H2O
B.充电时阴极电极反应式为:PbSO4+2e- Pb+SO42-
Pb+SO42-
C.充电时,若要使1molPbSO4转变为Pb和PbO2,则需要通过2mol电子
D.放电时,H+向负极移动
参考答案:B
本题解析:电池放电时:负极? Pb2+ + 2e-? +SO42- ="=" PbSO4
放电时正极电极反应式为:PbO2+4H+ + SO42-+2e- PbSO4+2H2O?则不正确。
PbSO4+2H2O?则不正确。
B正确:充电时阴极电极反应式为:PbSO4+2e- Pb+SO42-
Pb+SO42-
C不正确.充电时,若要使1molPbSO4转变为Pb和PbO2,则需要通过1mol电子
D不正确.放电时,阳离子向正极移动
本题难度:一般
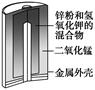
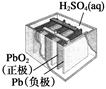
4、选择题 有关下列四个常用电化学装置的叙述中,正确的是(?)
| 
| 
| 
|
图Ⅰ 碱性
锌锰电池
| 图Ⅱ 铅?硫
酸蓄电池
| 图Ⅲ 电解
精炼铜
| 图Ⅳ 银锌
纽扣电池
|
?
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C.图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
参考答案:D
本题解析:A项,在干电池中MnO2作氧化剂,错误;B项,在铅蓄电池放电过程中,H2SO4的浓度不断减小,错误;C项,电解精炼铜时,电解质溶液中Cu2+的浓度减小,错误;D项正确。
本题难度:一般
5、选择题 有关如右图所示原电池(盐桥中装有含琼胶的KCl饱和溶液)的叙述,不正确的是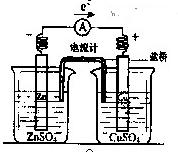
A.铜片上有红色物质附着
B.取出盐桥后,电流计依然发生偏转
C.反应中,盐桥中的K+会移向CuSO4溶液
D.锌片上发生氧化反应
参考答案:B
本题解析:原电池中,溶液中的阳离子在正极得电子,被还原。A正确;盐桥中的K+会移向CuSO4溶液,补充阳离子。C正确;锌片是负极,被氧化,D正确;B取出盐桥后,正负极断开,不构成原电池。
本题难度:一般