微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 必考题高锰酸钾是锰的重要化合物和常用的氧化剂.以下是工业上用软锰矿制备高锰酸钾的一种工艺流程.

(1)KMnO4稀溶液是一种常用的消毒剂.其消毒机理与下列?(填序号)物质相似.
A.75%酒精?B.双氧水?C.苯酚?D.84消毒液(NaClO溶液)
(2)写出MnO2、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:?.
(3)向K2MnO4溶液中通入CO2以制备KMnO4,该反应中的还原剂是:?.
(4)上述流程中可以循环使用的物质有石灰、二氧化碳、?和?(写化学式).
(5)若不考虑物质循环与制备过程中的损失,则1mol?MnO2可制得?mol?KMnO4.
参考答案:
本题解析:
本题难度:一般
2、填空题 在MnO2+4HCl?(浓)
MnCl2+Cl2↑+2H2O的反应中,用“双线桥法”表示氧化还原反应中电子转移情况;还原剂是______,氧化产物是______,该反应的离子方程式为______.
参考答案:在MnO2+4HCl?(浓)?△?.?MnCl2+Cl2↑+2H2O的反应中,锰元素化合价降低,氯元素化合价升高,转移电子数为2mol,用“双线桥法”表示氧化还原反应中电子转移情况为:
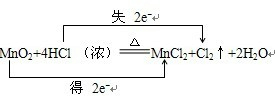
,氯元素化合价升高,还原剂是HCl,氧化产物是Cl2,反应的实质是:MnO2+4H++2Cl-(浓)?△?.?Mn2++Cl2↑+2H2O.
故答案为:HCl;Cl2;MnO2+4H++2Cl-(浓)?△?.?Mn2++Cl2↑+2H2O.
本题解析:
本题难度:一般
3、选择题 氧化还原反应的实质是( )
A.氧元素的得失
B.氢元素的得失
C.电子的得失或偏移
D.元素化合价的升降
参考答案:氧化还原反应的实质是电子的得失或偏移,而化合价的升降为氧化还原反应的特征,与氧元素、氢元素的得失没有关系,故选C.
本题解析:
本题难度:一般
4、填空题 在反应:Fe2O3+2Al
?Al2O3+2Fe?中,______元素的化合价升高,该元素的原子______电子,被______;______元素的化合价降低,该元素的原子______电子,被______;该反应中,______是氧化剂,______是氧化产物.
参考答案:在反应:Fe2O3+2Al?高温?.??Al2O3+2Fe中,化合价升高元素是铝元素,铝元素失去电子,被氧化,所在反应物金属铝是还原剂,对应产物Al2O3是氧化产物;
化合价降低元素是Fe2O3中的铁元素,铁元素得到电子,被还原,所在的反应物Fe2O3是氧化剂,对应产物Fe是还原产物.
故答案为:Al;失;氧化;Fe;得;还原;Fe2O3;Al2O3.
本题解析:
本题难度:一般
5、简答题 氯碱工业是用电解饱和食盐水的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品.总反应为:2NaCl+2H2O
2NaOH+Cl2↑+H2↑
(1)用单线桥表示该反应中电子转移的方向和数目:2NaCl+2H2O2NaOH+Cl2↑+H2↑该反应中氧化剂是______,还原剂是______.
(2)NaOH、Cl2和H2都是重要的化工生产原料,工业上可用它们中的两种物质生产漂白液,其反应的离子方程式为:______;此反应中氧化剂和还原剂的物质的量之比为______.
参考答案:(1)电解氯化钠溶液时,生成1mol氯气需要2mol电子,生成1mol氢气需要2mol电子,所以其转移电子数是2,
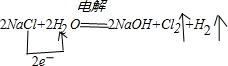
,该反应中,氯元素失电子化合价升高,所以氯化钠是还原剂,氢元素得电子化合价降低,所以水是氧化剂,
故答案为:H2O、NaCl;
(2)氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,反应离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,该反应中氯元素的化合价既有升高的也有降低的,所以氯气既是氧化剂又是还原剂,生成1mol氯离子需要1mol电子,生成1mol次氯酸根离子需要1mol电子,所以氧化剂和还原剂的物质的量之比是1:1,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O,1:1.
本题解析:
本题难度:一般