微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 关于反应K37ClO3+6H35Cl=KCl+3Cl2↑+3H2O的有关叙述中,正确的是(?)A
A.KCl中含有35Cl
B.KCl中含有37Cl
C.生成物Cl2的相对分子质量大于71
D.该反应转移的电子数为6e-
参考答案:C
本题解析:反应K37ClO3+6H35Cl=KCl+3Cl2↑+3H2O中,K37ClO3中CL元素的化合价由+5价降低到0价,而H35Cl中CL元素的化合价由—1升高到0价;所以正确选项为C;
本题难度:一般
2、填空题 (15分)C、Si、S和N元素在化学中占有极其重要的地位。
 (1)写出Si的基态原子价电子排布式 ?。
(1)写出Si的基态原子价电子排布式 ?。
从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为 。
 (2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为 ?,微粒间存在的作用力是 ?。
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为 ?,微粒间存在的作用力是 ?。
(3)氧化物MO的电子总数与SiC的相等,MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是 ?。
 (4)SO2、NO2、H2S同属于?结构(填“三角锥形”、“直线型”或“V字型”)。从微观结构角度分析,其中一种分子又与另二种分子有不同之处,该分子的化学式是?。
(4)SO2、NO2、H2S同属于?结构(填“三角锥形”、“直线型”或“V字型”)。从微观结构角度分析,其中一种分子又与另二种分子有不同之处,该分子的化学式是?。
参考答案::(1) 3s23p2(2分)?O>C>Si (2分)
(2)? sp3(2分)?共价键(2分)
(3) Mg2+半径比Ca2+小,MgO晶格能大(3分)
(4) V字型(2分)? H2S(2分)
本题解析::电负性同周期从前往后增加,从上至下减小,O>C>Si SiC的晶体结构与晶体硅的相似,都是原子晶体,C原子的杂化方式为sp3,微粒间存在的作用力是?共价键。离子晶体的晶格能越大,离子键越强,晶格能与原子半径成反比,与电荷数成正比。MgO的熔点比CaO的高,其原因是Mg2+半径比Ca2+小,MgO晶格能大. SO2、NO2、H2S是分子晶体,分子结构为V字型。H2S有2对孤电子,和其他两种不一样。
本题难度:一般
3、选择题 A、B、C、D四种元素,已知A元素是地壳中含量最多的元素;B元素为金属元素,它的原子核外K、L层上电子数之和等于M、N层电子数之和;C元素是第三周期第一电离能最小的元素;D元素在第三周期中第一电离能最大。下列有关叙述错误的是? (? )
A四种元素A、B、C、D分别为O、Ca、Na、Ar
B.元素A、B、C两两组成的化合物可为CaO、Ca02、Na2 0、 Na2 02等
C元素A、C简单离子的半径大小关系为A<C
D-元素A、C电负性大小关系为A>C
参考答案:C
本题解析:A元素是地壳中含量最多的元素,则A是O;B元素为金属元素,它的原子核外K、L层上电子数之和等于M、N层电子数之和,所以B是Ca;金属性越强,第一电离能越小,所以C是Na,D是Ar。核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,氧原子的质子数小于钠原子的质子数,所以氧离子半径大于钠离子半径,选项C不正确,其余 都是正确的,答案选C。
本题难度:一般
4、填空题 A、B、C、D、E、F均为短周期主族元素,且原子序数依次增大。短周期元素中C的原子半径最大,B、E同族,E的最外层电子数是电子层数的2倍,A的最高价氧化物水化物为H2AO3,D是地壳中含量最高的金属元素。
(1)A的元素符号是________,C2B2的电子式为________。
(2)B、C、D、F的离子半径由大到小的顺序是________(用离子符号表示)。
(3)E和F相比,非金属性强的是________(用元素符号表示),下列事实能证明这一结论的是________(用符号填空)。
①常温下E的单质呈固态,F的单质呈气态 ②气态氢化物的稳定性:F>E ③E和F形成的化合物中,E显正价 ④F单质能与E的氢化物发生置换反应 ⑤E和F的氧化物的水化物的酸性强弱 ⑥气态氢化物的还原性:E>F
(4)把CDB2溶液蒸干所得的固体物质为________(填化学式)。
(5)C和F可组成化合物甲,用惰性电极电解甲的水溶液,电解的化学方程式为__________________________。
(6)A、B、C三种元素组成的常见化合物乙的溶液中,离子浓度由大到小的顺序为________,pH=10的乙溶液中由水电离产生的c(OH-)=________mol·L-1。
参考答案:(1)C 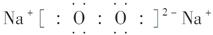
(2)Cl->O2->Na+>Al3+
(3)Cl ②③④⑥
(4)NaAlO2
(5)2NaCl+2H2O 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
(6)c(Na+)>c (CO32—)>c(OH-)>c(HCO3—)>c(H+) 10-4
本题解析:根据提供信息,A为C,B为O,C为Na,D为Al,E为S,F为Cl。(2)O2-、Na+、Al3+核外两个电子层,Cl-核外三个电子层,根据具有相同电子层结构的粒子,核电荷数越大,粒子半径越小,则离子半径大小为Cl->O2->Na+>Al3+。(3)S、Cl同周期,非金属性:Cl>S。①常温下单质的状态不能证明非金属性强弱;②气态氢化物越稳定,非金属性越强;③元素形成的化合物中显负价,说明得电子能力强,从而证明非金属性强;④非金属性强的元素对应的单质氧化性更强;⑤根据元素最高价氧化物的水化物酸性证明非金属性强弱,题中未标明最高价,不能证明;⑥气态氢化物还原性越弱,非金属性越强。
(6)Na2CO3溶液中由于CO32—水解溶液显碱性,pH=10的Na2CO3溶液中水的电离得到促进,由水电离出的c(OH-)=10-4 mol/L。
点拨:本题考查元素推断,考查考生对物质结构、元素周期律的理解能力。难度中等。
本题难度:一般
5、填空题 (11分)下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:(无特殊说明均填元素符号、化学式等化学用语)
主族
周期
| IA
| ⅡA
| IIIA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| 0族
|
1
| ①
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
2
| ?
| ?
| ?
| ?
| ②
| ③
| ?
| ④
|
3
| ⑤
| ⑥
| ⑦
| ?
| ?
| ⑧
| ⑨
| ?
|
4
| ⑩
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
(1)在这些元素中,化学性质最不活泼的元素名称是?,最高价氧化物对应的水化物是两性氢氧化物的元素是?,⑤⑥⑩元素中原子半径最大的元素为?。⑧号元素的原子结构示意图为?。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是?,碱性最强的化合物的化学式是?,⑧、⑨号元素的氢化物中还原性较强的是?。
(3)②与③形成的化合物属于?(填“共价”或“离子”)化合物。
(4)⑩号元素与水反应的化学方程式为?。
参考答案:氖 , Al ,K?各1分? ?(2分)?
?(2分)?
(2) HClO4、KOH、 H2S(各1分)
(3) 共价 (1分)?(4)2K+2H2O==2KOH+H2 ↑? (2分)
本题解析:考查元素周期表的结构和元素周期律的应用。根据元素在周期表中的位置可判断,①~⑩分别为H、N、O、Ne、Na、Mg、Al、S、Cl、K。同周期自左向右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强。同主族自上而下原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱,所以原子半径是K>Na>Mg。非金属性越强,相应氢化物的还原性就越弱,所以硫化氢的还原性大于氯化氢的。N和O都是非金属,形成的化学键是极性键。钾的金属性很强,与水反应剧烈,生成氢氧化钾和氢气。
本题难度:一般