微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列分子结构中,原子的最外电子都能满足8电子稳定结构的是(?)
A.XeF2
B.CO2
C.PCl5
D.HClO
参考答案:B
本题解析:在分子形成的过程中,原子都有趋向最外层电子层为8(或2)电子的“稳定结构”(稀有气体原子的结构)。离子化合物形成时,活泼的金属原子失去最外层的少数电子,形成稳定阳离子结构;活泼的非金属原子获得电子,最外层补足到8电子,形成稳定的阴离子结构。共价化合物形成时,原子间相互吸引对方的电子,组成共用电子对,形成8电子稳定结构。常见的稳定结构多为8电子结构,但也存在非电子结构的稳定状态。如对氢原子来说,最外层有2个电子,就达到稳定结构。
选项C的磷原子,最外层有5个电子,分别和5个氯原子结合,形成5个共用电子对,磷原子最外层形成10个电子结构。选项D中的次氯酸,含氧酸的结构是:+1价的氯原子和-1价的氢氧根原子团结合,也就是氧原子分别和氢原子、氯原子结合,氧原子达到8电子稳定结构,而氢原子仅能达到2电子的稳定结构。在选项A中,稀有气体氙原子的结构已是稳定结构,当它和氟原子结合时,最外层电子数必然超过8个。本题的正确选项只能是B,CO2的结构中,碳原子分别和两个氧原子形成碳氧双键,每个原子的最外层为8电子稳定结构。
本题难度:简单
2、选择题 下列说法正确的是
A.元素周期表有7个主族,7个副族,1个零族,1个Ⅷ族,共16纵行
B.X2+的核外电子数目为18,则X在第四周期第ⅡA族
C.Li是最活泼金属,F是最活泼非金属
D.NaOH碱性比KOH强
参考答案:B
本题解析:
元素周期表有7个主族,7个副族,1个零族,1个Ⅷ族,但第Ⅷ族有三个纵行,所以元素周期表共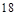 纵行,A错;
纵行,A错;
X2+的核外电子数目为18,则其原子序数为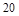 ,是
,是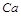 元素,在第四周期第ⅡA族,故B正确;
元素,在第四周期第ⅡA族,故B正确;
F元素的最外层有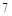 外电子,原子核对电子的引力很大,极易得到
外电子,原子核对电子的引力很大,极易得到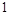 个电子达到最外层
个电子达到最外层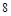 个电子的稳定结构,是最活泼非金属.碱金属随着核电核数的增加,原子半径逐渐增大,还原性增强,金属活性越来越强,所以Li不是最活泼金属,;故C错
个电子的稳定结构,是最活泼非金属.碱金属随着核电核数的增加,原子半径逐渐增大,还原性增强,金属活性越来越强,所以Li不是最活泼金属,;故C错
碱金属随着核电核数的增加,原子半径逐渐增大,还原性增强,金属活性越来越强,所以碱性逐渐增强,故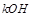 碱性比
碱性比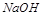 强,故D错
强,故D错
故正确答案为B
本题难度:一般
3、填空题 A、B、C、D、E五种元素均为短周期元素,原子序数逐渐增大。A形成的单质密度最小(相同条件下)。B可形成多种同素异形体,其中一种的硬度自然界中最大。D元素原子的最外层电子数是次外层电子数的3倍。E元素的最高价氧化物的水化物的酸性强于硫酸。
(1)元素C位于元素周期表的?周期?族,原子结构示意图为?。
(2)B、C、D三种元素的最简单氢化物的稳定性从大到小的顺序是?(填化学式),BE4分子的空间构型是?。
(3)元素A与B形成原子个数比为1:1的相对分子质量最小的化合物的结构式为?。
(4)A、B、C、D几种元素之间可以形成多种10电子微粒,写出上述10电子微粒之间反应的其中一个化学方程式或离子方程式:?
(5)写出E的单质制取漂白粉反应的化学方程式并标出电子转移的方向和数目:?
参考答案:(共16分)
(1)二? VA?(2分) (2分),
(2分),
(2)H2O>NH3>CH4(2分)?正四面体(2分)
(3) 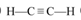 ?(2分)
?(2分)
(4)NH3+H2O=NH3·H2O或OH-十NH4+=NH3·H2O(2分)
(5)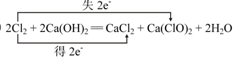 (化学方程式2分,电子转移2分,共4分)
(化学方程式2分,电子转移2分,共4分)
本题解析:根据题意可以推断A、B、C、D、E分别为H、C、N、O、Cl。10个电子的离子可以以氖为中心,氖前面的阴离子和氖后面的阳离子以及阴离子对应的氢化物、氢化物的阴阳离子等。H、C、N、O想到CH4、NH3(NH2-、NH4+)、H2O(H3O+、OH-)、HF等。Cl2与漂白粉的反应为歧化反应,在表电子转移是最好使用单线桥法(参考答案以及2012安徽高考卷均使用双线桥法,不知何意)
本题难度:一般
4、选择题 四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,则对下列叙述的判断正确的是(?)
①a-b=m-n
②元素的原子序数a>b>c>d
③元素非金属性Z>R
④最高价氧化物对应水化物的碱性X>Y
A.②③
B.③
C.①②③④
D.①②③
参考答案:D
本题解析:金属元素的原子失去电子变为阳离子,非金属元素的原子获得电子变为阴离子。原子失去或获得的电子越多,其所带的电荷就越多。根据题意可得:①a-m=b-n ,整理可得a-b=m-n。正确。由于这几种离子的电子层结构相同,Xm+、bYn+是阳离子,失去的电子m>n,所以原子序数a>b;cZn-和dRm-是阴离子,得到的电子m>n,所以原子序数c>d.。阳离子的原子序数大于阴离子的原子序数。所以元素的原子序数a>b>c>d.正确。③同一周期的元素,原子序数越大,元素非金属性越强,由于Z的原子序数大于R的原子序数,所以非金属性Z>R。正确。④同一周期的元素,原子序数越大,元素的金属性就越弱。原子序数X>Y。所以最是高价氧化物对应水化物的碱性Y>X。错误。
本题难度:一般
5、选择题 北京时间2012年9月14日,国外媒体报道,美国宇航局的“好奇”号火星车已经展开它的X射线分析器,并首次完成对火星物质元素成分的分析。下面这张图显示的是α粒子与X射线分光仪从某仪器获得的元素分析数据。多个峰值表明各种成分非常丰富,其中包括在火星大气里发现的氩,该仪器自身的铝,以及火星土壤微粒所含的硫黄和氯.

理解此图,判断下列说法错误的是
A.峰值最高的过渡元素在周期表中的位置是第四周期第Ⅷ副族
B.上述元素分析图中,同一周期的两种主族元素可形成1∶1型离子化合物只有一种,其电子式为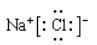
C.氯比硫的非金属性强的依据之一是HCl比H2S稳定
D.工业上常用电解氧化铝的方法制备铝
参考答案:B
本题解析:上述元素分析图中,同一周期的两种主族元素可形成1∶1型离子化合物有两种,还有硫化镁,其电子Mg2+ ,B项错误。
,B项错误。
本题难度:一般