微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 Mg2+和Al3+的混和溶液中逐滴加入NaOH溶液,形成沉淀的情况出现两种图示。图1为甲同学绘制,图2是乙同学根据实验结果绘制,查阅沉淀生成和Al(OH)3溶解的pH情况如表。下列说法正确的是(?)
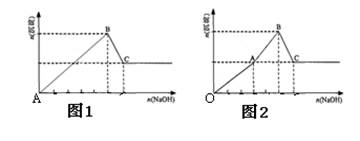

A.据图计算得n(Mg2+): n(Al3+)=2:1
B.图1实验中,OA段生成两种沉淀
C.根据上述信息得出对应的温度下:Ksp(Al(OH)3)> Ksp(Mg(OH)2)
D.结合表中数据和图2分析,AB段可能发生:Mg2++2AlO2—+4H2O =2Al(OH)3↓+Mg(OH)2↓
参考答案:D
本题解析:A 错误,据图计算得n(Mg2+): n(Al3+)=1:1
B 错误,图1实验中,没有标OA段
C 错误,上述信息只是给的开始沉淀的PH,没有给出离子浓度的大小,所以,得不到两者Ksp的大小
D 正确,镁离子和偏铝酸根离子发生双水解。
本题难度:一般
2、选择题 实验室用Al2(SO4)3制取Al(OH)3,最合适的试剂是? (? )
A.NaOH
B.H2SO4
C.NH3?H2O
D.KOH
参考答案:C
本题解析:由于氢氧化铝可溶于强碱,故用铝盐制取Al(OH)3时,一般选用弱碱,例如氨水
本题难度:简单
3、选择题 在1 L含0.1 mol NaAlO2和0.1 mol Ba(OH)2的混合溶液中,逐滴加入浓度为0.1 mol/L的H2SO4溶液,下列图象中能表示反应产生沉淀的物质的量与加入硫酸溶液体积之间关系的是(?)
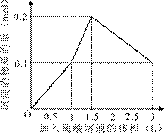 ?
?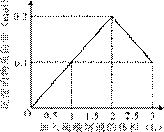 ?
?
A ?B
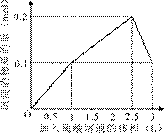 ?
?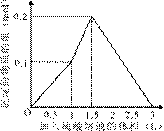
C? D
参考答案:A
本题解析:略
本题难度:一般
4、选择题 下列物质中,属于两性氧化物的是
[? ]
A. CO2
B. CaO
C. Al2O3
D. CuO
参考答案:C
本题解析:
本题难度:简单
5、简答题 A、B、C、D、E、F、G七种短周期元素的原子序数依次增大.A和E最外层电子数相同,短周期主族元素的原子中,E原子的半径最大;B、C和F在周期表中相邻,B、C同周期,C、F同主族,F原子的质子数是C原子质子数的2倍;A和C可形成两种常见的液态化合物X和Y(相对分子质量X<Y?);D形成的分子为单原子分子.回答问题:
(1)D元素的名称为______,F形成的离子的结构示意图为______.
(2)写出液态化合物Y的一种用途______.
(3)用某种金属易拉罐与A、C、E组成的化合物的水溶液反应,产生的气体可充填气球,请写出该反应的离子方程式______,使用这种气球存在的隐患是______.
(4)P和Q两种物质都是由A、C、E、F四种元素组成的盐,其水溶液都显酸性,等物质的量的P和Q恰好完全反应.写出该反应的离子方程式:______.
(5)由A、B两元素形成的化合物W可作为火箭推进器中的强还原剂,已知一个W分子和一个Y分子中都含有18个电子,0.5mol液态W和足量液态Y反应,生成一种无色无味无毒的气体B2和液态X,并放出408.8kJ热量.查资料可知:
2Y(1)=2X(1)+C2(g)△H=-196.4kJ?mol-1写出液态W与气态C2反应生成液态X和气态B2的热化学方程式为______.该反应还可设计为原电池(以KOH溶液为电解质溶液),请写出该电池的负极反应式:______.
(6)G为氯,以K2CrO4为指示剂,用标准硝酸银溶液可以测定溶液中Cl-的浓度,已知Ksp(AgCl)=1.56ⅹ10-10,Ksp(Ag2CrO4)=1.10ⅹ10-12,Ag2CrO4为砖红色,则滴定终点的现象是______.
参考答案:由短周期主族元素的原子中,A、B、C、D、E、F、G七种短周期元素的原子序数依次增大,E原子的半径最大,则E为钠元素;C、F同主族,F原子的质子数是C原子质子数的2倍,则C为氧元素,F为硫元素;因G的原子序数大于F,则G为氯元素;B、C和F在周期表中相邻,B、C同周期,则B为氮元素;A和E最外层电子数相同,A和C可形成两种常见的液态化合物X和Y,X、Y为水和双氧水,则A为氢元素;D形成的分子为单原子分子,D的原子序数介于8~11,则D为氖元素;
(1)因D为氖元素,则名称为氖,F为硫元素,硫离子带2各单位的负电荷,质子数为16,电子数为18,最外层电子数为8,其离子结构示意图为
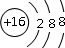
,故答案为:氖;
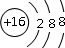
;
(2)A和C可形成两种常见的液态化合物X和Y(相对分子质量X<Y?),则Y为H2O2,因其具有氧化性,则可作消毒剂,故答案为:一定浓度的H2O2溶液作消毒剂;
(3)A、C、E组成的化合物的水溶液为NaOH溶液,金属易拉罐含铝,则发生的离子反应为
2Al+2OH-+2H2O=2AlO2-+3H2↑,生成的氢气易燃、易爆,则存在安全隐患,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;易燃、易爆;
(4)A、C、E、F四种元素组成的盐,其水溶液都显酸性,等物质的量的P和Q恰好完全反应,则该反应为硫酸氢钠和亚硫酸氢钠的反应,其离子反应为H++HSO3-=H2O+SO2↑,故答案为:H++HSO3-=H2O+SO2↑;
(5)由A、B两元素形成的化合物W,一个W分子和一个Y分子中都含有18个电子,0.5mol液态W和足量液态Y反应,生成一种无色无味无毒的气体B2和液态X,并放出408.8kJ热量,该反应的热化学方程式为
N2H4(1)+2H2O2(1)=N2(g)+4H2O(1)△H=-817.6kJ?mol-1、、、、①,
由2Y(1)=2X(1)+C2(g)△H=-196.4kJ?mol-1,即2H2O2(1)=2H2O(1)+O2(g)△H=-196.4kJ?mol-1、、、、②,①-②可得N2H4(1)+O2(g)=N2(g)+2H2O(1)△H=-621.2kJ?mol-1,
该反应还可设计为原电池,在负极N元素失去电子,电极反应为N2H4-4e-+4OH-=N2+4H2O,
故答案为:N2H4(1)+O2(g)=N2(g)+2H2O(1)△H=-621.2kJ?mol-1;N2H4-4e-+4OH-=N2+4H2O;
(6)由Ksp(AgCl)=1.56ⅹ10-10,Ksp(Ag2CrO4)=1.10ⅹ10-12,
转化为AgCl沉淀需要的c(Ag+)=
本题解析:
本题难度:一般