微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关于氯气的表述正确的是( )
A.氯气是无色、无味的气体
B.纯净的液态氯不能储存在钢瓶中
C.氯水有酸性和漂白杀菌作用
D.氯气很难与金属和非金属直接化合
参考答案:A、氯气是黄绿色、有刺激性气味的气体,故A错误;
B、常温下液氯不与铁反应,所以纯净的液态氯可以储存在钢瓶中,故B错误;
C、氯水中含有次氯酸具有漂泊性、强氧化性能漂白杀菌的作用,故C正确;
D、氯气是一种活泼非金属单质,在加热条件下易与金属、非金属反应,故D错误;
故选C.
本题解析:
本题难度:简单
2、实验题 实验室用足量MnO2与浓盐酸反应制取氯气,其装置如图1所示:
 ?
?
图1?图2
(1)图1中仪器a的名称是:?;仪器b的名称是:?;b中加入碎瓷片的作用是:?。
(2)请写出仪器b中发生的反应的离子方程式:?
(3)检查装置的气密性之后的操作依次是:?、?、?。(填序号)
A.向烧瓶中加入MnO2粉末
B.加热
C.向烧瓶中加入浓盐酸
(4)该反应会因为盐酸浓度下降而停止。为了测定反应残留液中盐酸的浓度,某探究小组提出下列实验方案:
①甲同学的方案为:与足量AgNO3溶液反应,称量生成沉淀的质量。
②乙同学的方案为:与足量的锌反应,测量生成气体的体积,实验装置如图2所示(夹持装置已略去)。使Y形管中的残留溶液与锌粒反应的正确操作是?(“锌粒转移到残留溶液中”或“残留溶液转移到锌粒中”)。在正确读取量气管读数时,视线要平视,要注意使漏斗液面与量气管中液面相平,除此外还须注意:?。
两种方案我认为?(填甲或乙)同学的方案可行。
参考答案:(1)分液漏斗; 蒸馏烧瓶; 防止液体暴沸
(2)MnO2+4H++2Cl-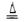 Mn2++2H2O+Cl2↑
Mn2++2H2O+Cl2↑
(3)A、C、B
(4)锌粒转移至残留溶液中; 恢复至室温; 乙
本题解析:图1装置有分液漏斗和蒸馏烧瓶组装而成,加入碎瓷片防止爆沸,检验气密性后,先加入固体,再加液体,最后加热,自下而上,MnO2+4H++2Cl-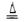 Mn2++2H2O+Cl2↑,盐酸表现还原性和酸性,甲同学检验的是氯离子的量,包括的除了剩余的盐酸,还有表现酸性的盐酸,也就是氯化锰的氯离子。乙同学把锌粒转入盐酸中,保证盐酸完全反应,准确测定盐酸的量,量气管读数时注意:1、回复至室温,2、调节液面相平,3、视线与凹液面相切。
Mn2++2H2O+Cl2↑,盐酸表现还原性和酸性,甲同学检验的是氯离子的量,包括的除了剩余的盐酸,还有表现酸性的盐酸,也就是氯化锰的氯离子。乙同学把锌粒转入盐酸中,保证盐酸完全反应,准确测定盐酸的量,量气管读数时注意:1、回复至室温,2、调节液面相平,3、视线与凹液面相切。
本题难度:一般
3、选择题
A.0.35
B.<0.35
C.>0.35
D.≤0.35
参考答案:C
本题解析:方法1(条件转换法):先把“等体积”看作“等质量”,则等质量混合后溶液中 HNO3的质量分数为:
w混=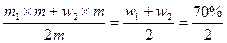 =35%
=35%
而等体积混合时水的质量小于 HNO3(aq) 的质量,则等体积混合相当于先进行等质量混合,然后再加入一定量的密度大的液体,这里是 70% 的 HNO3(aq),故其质量分数大于 35%。
方法2(数轴表示法):(1)先画一数轴,在其上标出欲混合的两种液体中溶质的质量分数,并在两质量分数的对应点上标出两液体密度的相对大小。
7
本题难度:一般
4、简答题 (14分)
研究小组用下图装置制取Cl2,证明产生的气体中含有HCl。

(1)仪器A的名称为?;A中反应的离子方程式为?。
(2)甲同学将A中产生的气体通入下列溶液:
实验序号
| 试剂
| 现象
|
a
| 紫色石蕊溶液
| ??
|
b
| AgNO3溶液
| 出现白色沉淀
|
①实验a中的现象为?。
②不能证明产生的气体中含有HCl的实验是?(填字母序号)。
(3)已知将HCl气体通入饱和食盐水中有白色固体析出。乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有HCl,结合化学用语解释其原因:?。
(4)已知:2S2O32- + I2 ="==" S4O62- + 2I-。丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有HCl。
I.测定X中溶解的Cl2。取25.00 mL溶液X,加入过量KI溶液,然后用0.04 mol?L-1 Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O3溶液V mL。
II.测定X中Cl元素总量。另取25.00 mL溶液X,选用适当的还原剂将溶解的Cl2全部还原为Cl-,再用0.10 mol?L-1 AgNO3溶液滴定所得溶液中的Cl-。
X中的HClO不会影响I的测定结果,原因是?。
由I、II 中实验数据可证明A中产生的气体中含有HCl,则II中消耗0.10 mol?L-1 AgNO3溶液的体积应大于?mL(用含V的代数式表示)。
参考答案:(14分)
(1)圆底烧瓶(1分)? 4H++2Cl-+MnO2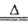 2H2O + Cl2↑+Mn2+
2H2O + Cl2↑+Mn2+
(2)①溶液先变红再褪色 ②a、b
(3)Cl2+ H2O HCl+HClO,Cl2溶于水后使得溶液中的c(Cl-)增大,也能析出晶体。
HCl+HClO,Cl2溶于水后使得溶液中的c(Cl-)增大,也能析出晶体。
(4)(3分)
①答案一:生成1 mol HClO需消耗1 mol Cl2(1分), HClO也有氧化性,1 mol HClO和1 mol Cl2均能将2 mol KI氧化成I2(2分)。
答案二: Cl2+ H2O HCl+HClO,Cl2发生反应时,上述平衡逆向移动,相当于Cl2全部参与氧化I-的反应。
HCl+HClO,Cl2发生反应时,上述平衡逆向移动,相当于Cl2全部参与氧化I-的反应。
②0.4V
本题解析:(1)仪器A的名称为圆底烧瓶;A是二氧化锰与浓盐酸制取氯气的反应,离子方程式为4H++2Cl-+MnO2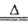 2H2O + Cl2↑+Mn2+
2H2O + Cl2↑+Mn2+
(2)①氯气溶于水生成氯化氢和次氯酸,溶液呈酸性,所以石蕊试液变红;次氯酸具有漂白性,随后溶液红色褪去;
②ab都不能证明产生的气体中含有HCl。因为氯气溶于水生成氯化氢,所以即使产生的气体中不含氯化氢,石蕊试液也会变红;同时生成的氯化氢与硝酸银溶液反应生成氯化银沉淀,不能说明产生的气体中有氯化氢;
(3)氯气与水反应生成氯化氢和次氯酸,Cl2+ H2O HCl+HClO,Cl2溶于水后使得溶液中的c(Cl-)增大,也能析出晶体。
HCl+HClO,Cl2溶于水后使得溶液中的c(Cl-)增大,也能析出晶体。
(4)①生成1 mol HClO需消耗1 mol Cl2, HClO也有氧化性,1 mol HClO和1 mol Cl2均能将2 mol KI氧化成I2,所以HClO的存在不影响实验结果;或者Cl2+ H2O HCl+HClO,Cl2氧化KI时,上述平衡逆向移动,相当于Cl2全部参与氧化I-的反应。
HCl+HClO,Cl2氧化KI时,上述平衡逆向移动,相当于Cl2全部参与氧化I-的反应。
②I中测定Cl2的物质的量是0.04 mol?L-1×V×10-3L×1/2,则转化为Cl-的物质的量是0.04V×10-3mol;不考虑气体中的氯化氢,氯气转化的Cl-需要硝酸银的体积是0.04V×10-3mol/0.1mol/L=0.4VmL,所以II中消耗0.10 mol?L-1 AgNO3溶液的体积应大于0.4VmL,说明气体中含有HCl。
本题难度:一般
5、填空题 现用如图1所示的装置制取较多量的饱和氯水并测定饱和氯水的pH.回答有关问题: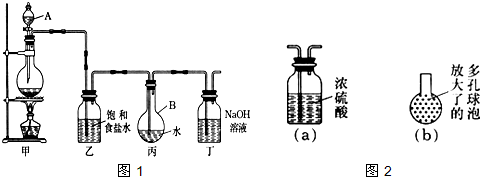
(1)写出有关化学方程式.
装置甲:______;
装置丁:______.
(2)证明氯水已饱和的现象是______.
(3)制取结束时,装置丙的液体中含有最多的微粒是______(水分子除外);装置乙的作用是______.
(4)有如下改进措施或建议,请作出评价:
①在装置乙和丙之间增加如图2(a)所示的装置,你认为有无必要?______.
②在装置丙的长导管下口处,接如图2(b)所示的多孔球泡,这样做的好处是:______.
③若撤去装置乙,直接将装置甲和丙相连.这样做对实验结果的影响是:______.
参考答案:(1)实验室制取氯气的反应原理:MnO2+4HCl(浓) △.MnCl2+Cl2↑+2H2O,氯气能和碱反应反应氯化钠、次氯酸钠和水,方程式为:2NaOH+Cl2=NaCl+NaClO+H2O;
故答案为:MnO2+4HCl(浓) △.MnCl2+Cl2↑+2H2O;2NaOH+Cl2=NaCl+NaClO+H2O;
(2)因饱和溶液中不能溶解氯气以及氯气为黄绿色,所以丙中的导管有气泡溢出水面,且液面上方充满黄绿色气体即可证明氯水已饱和,
故答案为:丙中的导管有气泡溢出水面,且液面上方充满黄绿色气体;
(3)由氯水中成分可知,氯水中含有最多的微粒除了水就是氯气;饱和食盐水来除去氯气中的氯化氢;
故答案为:Cl2;除去氯气中的氯化氢;
(4)①因氯气中含水对制备氯水无影响,所以在装置乙和丙之间不需要增加如图2(a)所示的装置;故答案为:无;
②因多孔球泡的表面积大,能加快氯气溶解的速率,故答案为:增加氯气与水的接触面积,利于氯气溶解;
③因氯气中含有氯化氢,氯化氢溶于水,溶液酸性增强,使测定的pH减小,
故答案为:使测定的pH减小;
本题解析:
本题难度:一般