微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 关于可逆反应达到平衡状态的说法错误的是( )
A.达平衡时正、逆反应速率相等
B.是动态平衡
C.各组分的含量不随时间而变化
D.外界条件不能改变平衡
参考答案:A、正、逆反应速率相等是化学平衡的标志,故A正确;
B、化学平衡是动态平衡,正逆反应速率均相等但是均不等于零,故B正确;
C、达到化学平衡时,各组分的含量不随时间的改变而变化,故C正确;
D、可逆反应达到平衡状态时,外界条件改变可能会导致化学平衡的移动,其中温度一定会引起化学平衡的移动,故D错误.
故选D.
本题解析:
本题难度:一般
2、填空题 二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:
(i)CO(g) + 2H2(g) = CH3OH(g)? △H1 = -90.1kJ?mol-1
(ii)CO2(g) + 3H2(g) = CH3OH(g) + H2O(g)? △H2?= -49.0kJ?mol-1
水煤气变换反应:
(iii)CO(g) + H2O(g) = CO2(g) + H2 (g)? △H3?= -41.1kJ?mol-1
二甲醚合成反应:
(iV)2 CH3OH(g) = CH3OCH3(g) + H2O(g)? △H4?= -24.5kJ?mol-1
回答下列问题:
(1)Al2O3是合成气直接制备二甲醚反应催化剂的主要成分之一。工业上从铝土矿制备较高纯度Al2O3的主要工艺流程是?(以化学方程式表示)。
(2)分析二甲醚合成反应(iV)对于CO转化率的影响?。
(3)由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为?。根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响?。
(4)有研究者在催化剂(含Cu—Zn—Al—O和Al2O3)、压强为5.0MPa的条件下,由H2和CO直接制备二甲醚,结果如下图所示。其中CO转化率随温度升高而降低的原因是?。
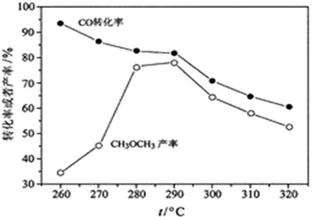
(5)二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度等于甲醇直接燃料电池(5.93kW?h?kg-1)。若电解质为酸性,二甲醚直接燃料电池的负极反应为?,一个二甲醚分子经过电化学氧化,可以产生?个电子的能量;该电池的理论输出电压为1.20V,能量密度E = ?(列式计算。能量密度=电池输出电能/燃料质量,1 kW?h = 3.6×106J)。
参考答案:
(1)Al2O3(铝土矿) + 2NaOH + 3H2O = 2NaAl(OH)4
NaAl(OH)4 + CO2?= Al(OH)3↓ + NaHCO3,2Al(OH)3 Al2O3+ 3H2O
Al2O3+ 3H2O
(2)消耗甲醇,促进甲醇合成反应(i)平衡右移,CO转化率增大;生成的H2O,通过水煤气变换反应(iii)消耗部分CO。
(3)2CO(g) + 4H2(g) = CH3OCH3 + H2O(g)? △H?= -204.7kJ?mol-1?
该反应分子数减少,压强升高使平衡右移,CO和H2转化率增大,CH3OCH3产率增加。压强升高使CO和H2浓度增加,反应速率增大。
(4)反应放热,温度升高,平衡左移。
(5)CH3OCH3 + 3H2O = 2CO2 + 12H+ + 12e-? 12
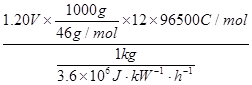 =8.39kW·h·kg-1
=8.39kW·h·kg-1
本题解析:
(1)从铝土矿制备较高纯度Al2O3的主要工艺流程:铝土矿用氢氧化钠溶液溶解,Al2O3+ 2NaOH + 3H2O = 2NaAl(OH)4,铝元素在溶液中以NaAl(OH)4存在,在溶液中通入二氧化碳气体进行酸化,NaAl(OH)4 + CO2?= Al(OH)3↓ + NaHCO3,过滤得到Al(OH)3沉淀,高温煅烧,2Al(OH)3 Al2O3+ 3H2O,得到较高纯度Al2O3。
Al2O3+ 3H2O,得到较高纯度Al2O3。
(2)根据四个反应方程式可知:二甲醚合成反应(iV)中消耗甲醇,促进甲醇合成反应(i)平衡右移,CO转化率增大;生成的H2O,通过水煤气变换反应(iii)消耗部分CO。
(3)根据题目所给条件和盖斯定律,由H2和CO直接制备二甲醚的热化学方程式为2CO(g) + 4H2(g) = CH3OCH3 + H2O(g)? △H?= -204.7kJ?mol-1。该反应为分子数减少的反应,增加压强使平衡右移,CO和H2转化率均增大,CH3OCH3产率增加。增加压强使CO和H2浓度增加,反应速率增大。
(4)由H2和CO直接制备二甲醚,由于该反应是放热反应,随温度升高,平衡逆向移动,CO转化率随温度升高而降低。
(5)根据反应产物,二甲醚直接燃料电池的负极反应为CH3OCH3+3H2O-12e-=
2CO2+12H+,根据方程式可知:一个二甲醚分子经过电化学氧化,可以产生12个电子的能量;根据能量密度的计算公式,E = 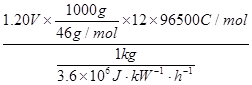 =8.39kW·h·kg-1。
=8.39kW·h·kg-1。
【考点定位】反应速率、化学平衡、电化学、化学计算
本题难度:一般
3、选择题 在一定条件下,密闭容器中发生可逆反应2X(g)+2Y(g) 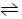 3Z(g)+2W(g),该X、Y的初始浓度分别为3.0 mol·L-1和1.0 mol·L-1,达平衡后,测出下列各生成物的浓度数据中肯定错误的是?(?)?
3Z(g)+2W(g),该X、Y的初始浓度分别为3.0 mol·L-1和1.0 mol·L-1,达平衡后,测出下列各生成物的浓度数据中肯定错误的是?(?)?
A c(Z)=0.75 mol·L-1? B c(Z)=1.2 mol·L-1
C c(W)=0.80 mol·L-1? D c(W)=1.0 mol·L-1
参考答案:D
本题解析:
答案:D
2X(g)+2Y(g)  3Z(g)+2W(g)
3Z(g)+2W(g)
3.0? 1.0? 1.5? 1.0
c(Z)<1.5 mol·L-1, c(W)<1.0 mol·L-1,所以D选项不可能。
本题难度:简单
4、选择题 在一定条件下,反应?2SO2(g)+O2(g)

2SO3(g)达到最大限度时,下列说法正确的是( )
A.反应完全停止,不再继续进行
B.混合物中SO2、O2、SO3的分子数比为2:1:2
C.等温等压下,气体的体积为开始时的三分之二
D.反应混合物的平均摩尔质量不再改变
参考答案:A.化学反应达到平衡状态时,正逆反应速率相等,但反应没有停止,故A错误;
B.可逆反应达到平衡状态时,反应物和生成物同时存在,物质的分子数不能确定,取决于起始配料比和反应的转化程度,故B错误;
C.反应为可逆反应,不可能完全转化,且起始的反应物的物质的量比不同,平衡时的物质的量不能确定,故C错误;
D.方程式中反应物与生成物化学计量数不相等,当达到平衡状态时,物质的总物质的量不变,气体的质量不变,则混合物的平均摩尔质量不再改变,故D正确.
故选D.
本题解析:
本题难度:简单
5、选择题 在密闭容器中发生下列反应;aA(g) cC(g)+dD(g),达到平衡后将气体体积压缩到原来的一半,当再次达到新平衡时,D的浓度为原来的1.8倍,下列说法正确的是
cC(g)+dD(g),达到平衡后将气体体积压缩到原来的一半,当再次达到新平衡时,D的浓度为原来的1.8倍,下列说法正确的是
①平衡向正反应方向移动了?②平衡向逆反应方向移动了
③A的转化率增大?④正、逆速率都增大
A.②④
B.①③
C.③④
D.①②
参考答案:A
本题解析:反应达到平衡后将气体体积压缩到原来的一半,假如平衡不发生移动,则D的浓度应该为原来的2倍。现在是原来的1.8倍,说明增大压强,化学平衡向逆反应方向移动。根据勒夏特列原理,增大压强,平衡向气体体积减小的方向移动。即逆反应方向是气体体积减小的方向。这时反应物的转化率降低。因为增大压强,各种物质的浓度都增大,所以正反应、逆反应的速率都增大。故正确说法为②④。选项为A。
本题难度:一般