|
高考化学知识点归纳《物质的量》考点预测(2017年强化版)(十)
2017-07-27 10:47:39
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列溶液中氯离子的物质的量浓度与50 mL 1 mol·L-1AlCl3溶液中氯离子的物质的量浓度相等的是
A.150 mL 3 mol·L-1氯酸钠溶液
B.75 mL 3 mol·L-1氯化钙溶液
C.150 mL 3 mol·L-1氯化钾溶液
D.50 mL 3 mol·L-1氯化镁溶液
|
参考答案:C
本题解析:根据氯化铝的化学式可知,50mL 1mol/L的AlCl3溶液中Cl-浓度3mol/L,而在选项ABCD中,氯离子浓度分别是(mol/L)0、6、3、6,所以答案选C。
本题难度:一般
2、选择题 下列说法正确的是?
A.H2的摩尔质量是2 g
B.1molH2O 的质量是18 g
C.氧气的摩尔质量是32
D.11.2L N2的质量为14 g
参考答案:B
本题解析:A项单位错误,C项缺少单位,D项没有注明温度和压强根据体积不能确定物质的量。答案选B。
点评:本题主要考查物理量与单位的关系,非常简单基础。
本题难度:简单
3、选择题 科学家刚刚发现了某种元素的原子,其质量是a g ,?12C的原子质量是b g,NA是阿伏加德罗常数的值,下列说法正确的是( )
A.W g该原子中含有aNA该原子
B.由已知信息可得:NA=
C.该原子的摩尔质量是aNA
D. W g该原子的物质的量一定是mol
参考答案:D
考点:阿伏加德罗常数、摩尔质量、物质的量
本题解析::A根据题意可知W g该原子中含有该原子的个数应为 ?,此项错误。 ?,此项错误。
B阿伏伽德罗常量(Avogadro’s constant,符号:NA)是物理学和化学中的一个重要常量。它的数值为:一般计算时取6.02×1023。它的正式的定义是0.012千克碳12中包含的碳12的原子的数量。即NA= ?此项错误。 ?此项错误。
C单位物质的量的物质所具有的质量称为摩尔质量(molar mass),用符号M表示。当物质的质量以克为单位时,摩尔质量的单位为g/mol,在数值上等于该物质的相对原子质量或相对分子质量。对于某一纯净物来说,它的摩尔质量是固定不变的,而物质的质量则随着物质的物质的量不同而发生变化。即:该原子的摩尔质量= = = 此项错误。 此项错误。
D根据物质的量的计算公式可知:n=  =mol 此项正确。 =mol 此项正确。
本题难度:简单
4、简答题 化学是一门以实验为基础的学科,熟练使用中学化学实验中的常见仪器,熟悉常见实验用品是正确进行实验的基础.试回答以下问题:
实验室需要0.1mol?L-1?NaOH溶液450mL和0.5mol?L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是______(填序号),配制上述溶液还需用到的玻璃仪器是______(填仪器名称).
(2)下列操作中,容量瓶所不具备的功能有______(填序号).
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.量取一定体积的液体
F.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为______g.在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度______0.1mol?L-1(填“大于”、“等于”或“小于”).
(4)根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为______mL(计算结果保留一位小数).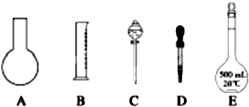
参考答案:(1)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水),冷却后转移到100mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、筒量、玻璃棒、容量瓶、胶头滴管,所以不需要的仪器是AC,还需要的仪器是烧杯和玻璃棒.
故答案为:AC;玻璃棒、烧杯;
(2)容量瓶不能用于贮存、加热溶液,溶解固体溶质等,只有1个刻度线不能测量容量瓶规格以下的任意体积的液体,故答案为:BCEF;
(3)m=nM=CVM=0.1mol/L×0.5L×40g/mol=2g,在容量瓶中定容时俯视容量瓶刻度线,导致溶液的体积偏小,所以配制溶液的浓度偏大,故答案为:2.0;大于;
(4)浓硫酸的物质的量浓度为:c=103ρwM=103×1.84×98%98mol/L=18.4mol/L;设需要浓硫酸的体积为V,0.5mol/L×0.5L=18.4mol/L×V,V=0.0136L=13.6mL,故答案为:13.6.
本题解析:
本题难度:一般
5、计算题 配制250ml 1.0 mol/L 的Na2CO3溶液,需称取Na2CO3固体多少克?取配制好的溶液25ml,往其中逐滴滴加1.0 mol/L的H2SO4溶液15ml,求生成的气体在标准状况下的体积是多少升?
参考答案:26.5g, 0.005mol,0.112L
本题解析:n(Na2CO3)=250ml*10-3L/ml*1.0mol/L=0.25mol; m(Na2CO3)=nM=0.25mol*106g/mol =26.5g;n(H+)=2n(H2SO4)=2*15ml*10-3L/ml*1.0mol/L=0.03mol
CO32-?+? H+? =? HCO3-
1? 1? 1
0.025mol? 0.025mol? 0.025mol
HCO3-?+? H+? =? H2O? +? CO2
1? 1? 1
0.30-0.025? n
 ? n? = 0.005mol ? n? = 0.005mol
V(CO2)=n*Vm=0.005mol*22.4L/mol? =0.112L
本题难度:一般
|