微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)Ⅰ、氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用。回答下列问题:(1)氮元素原子的L层电子数为__________;
(2) NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为_________________________;
(3) 肼-空气燃料电池是一种碱性电池,该电池放电时,正极的反应式为________________________________。
Ⅱ、一定质量的液态化合物XY2在标准状况下的一定质量的O2中恰好完全燃烧,反应方程式为: XY2(l)+3O2 (g) ="==" XO2(g)+2YO2 (g)冷却后,在标准状况下测得生成物的体积是672 mL,密度是2.56g/L则: (1)反应前O2的体积是________。(2)化合物XY2的摩尔质量是___________。
(3)XY2分子中X、Y两元素质量比是3∶16, X、Y两元素分别为__________ (写元素符号)。
参考答案:、12分) (每空2分)
Ⅰ (1)5? (2)2NH3+NaClO=N2H4+NaCl+H2O
(3)O2+2H2O +4e-=4OH-
 ?(1)672 mL? (2)76 g/mol? (3)C?、 S
?(1)672 mL? (2)76 g/mol? (3)C?、 S
本题解析:Ⅰ (1)根据原子核外电子的排布规律可知,氮元素原子的L层电子数为5个。
(2)根据原子守恒可知,还有氯化钠和水生成,所以反应的方程式是
2NH3+NaClO=N2H4+NaCl+H2O。
(3)原电池中分解失去电子,正极得到电子,所以正极是氧气得到电子。电解质溶液显碱性,所以正极电极反应式是O2+2H2O +4e-=4OH-。
Ⅱ、(1)根据反应的方程式可知,反应前后体积是不变的,所以反应前氧气的体积是672ml。
(2)氧气的物质的量是0.03mol,质量是0.96g。反应后气体的质量是0.672L×2.56g/L=1.72032,所以根据质量守恒定律可知,参加反应的XY2的质量是0.76032g。又因为XY2的物质的量是0.01mol,所以该化合物的摩尔质量是0.76032g÷0.01mol=76g/mol。
(3)根据化学式可知,X、Y两元素的摩尔质量之比是6︰16=12︰32,所以X是C,Y是S。
本题难度:一般
2、填空题 (14分)碳氧化物和氨氧化物在工业生产中有着广泛应用。
(1)工业上利用CO和H2在催化剂存在下合成甲醇。
主反应:CO(g)+2H2(g)=CH3OH(g)?△H=-91kJ.mo1-1
副反应:2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g)?△H=-206 kJ.mo1-1
①反应2CH3OH(g)=CH3OCH3(g)+H2O(g)的△H=?kJ.mo1-。
②工业中常用醇为燃料制成燃料电池(如右图所示),通入甲醇的电极是?极(填“正”或“负”);该电池的正极反应式为?。
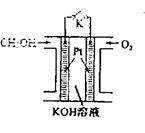
(2)氮氧化物进入大气后,可形成硝酸型酸雨和光化学烟雾,必须对其进行处理。
①用过量的NaOH溶液吸收NO2气体,所得的溶液中除了含有NaOH,还含有?。
②为避免污染,常给汽车安装尾气净化装置。净化装置里装有催化剂,气体在催化剂表面吸附与解吸作用的机理如右图所示。写出净化过程中的总化学反应方程式:?。

③某工厂排出的尾气中NOx的含量为0.56%(体积分数),用氨气可以将其转化为无害气体,发生的反应为:6NOx+4xNH3=(3+2x)N2+6xH2O若处理1×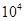 L(标准状况)该尾气需42.5gNH3,则x=?。
L(标准状况)该尾气需42.5gNH3,则x=?。
参考答案:(1)①-24(3分)②负(2分) O2+2H2O+4e-=4OH-(2分)
(2)①NaNO2、NaNO3(或答物质名称)(2分)
②2NO+O2+4CO 4CO2+N2(2分)③1.5(3分)
4CO2+N2(2分)③1.5(3分)
本题解析:(1)①根据盖斯定律可知,②-①×2即得到2CH3OH(g)=CH3OCH3(g)+H2O(g),所以反应热△H=-206 kJ.mo1-1+91kJ.mo1-1×2=-24 kJ.mo1-1。
②原电池中负极失去电子,正极得到电子,所以甲醇在负极通入,氧气在正极通入。由于电解质是氢氧化钾,所以正极反应式为O2+2H2O+4e-=4OH-。
(2)①NO2和氢氧化钠反应时,发生氧化还原反应,所以生成物是硝酸钠、亚硝酸钠和水。
②根据图示可知,生成物是CO2和氮气,所以方程式为②2NO+O2+4CO 4CO2+N2。
4CO2+N2。
③42.5gNH3是2.5mol,NOX的物质的量是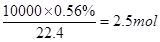 ,所以根据方程式可知4x=6,即x=1.5。
,所以根据方程式可知4x=6,即x=1.5。
本题难度:一般
3、实验题 (16分)某化学兴趣小组欲设计使用如下装置验证:铜和一定量的浓硝酸反应有一氧化氮产生。(假设气体体积均为标准状况,导气管中气体体积忽略不计,且忽略反应中的溶液体积变化)
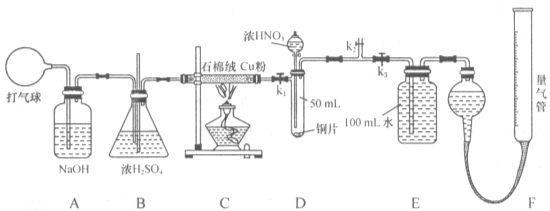
试回答下列问题:
(1)将铜粉分散在石棉绒中的原因是________________________________;
(2)在铜和浓硝酸反应前,挤压打气球,经A、B、C反应后,进入D中的气体是__?_(填化学式),通入该气体的目的是____________________?; 进行此步操作时应关闭_________,打开_________ (填k1、k2或k3);
进行此步操作时应关闭_________,打开_________ (填k1、k2或k3);
(3)若C装置的硬质玻璃管中出现堵塞,则B中可能出现的现象是___________________?;
(4)关闭k1、k2,打开k3,由分液漏斗向D中滴加浓硝酸。待Cu和浓硝酸反应结束后,再通过分液漏斗向D中加入CCl4至满。则D中一定发生反应的离子方程式为:_________?;
(5)若E中出现倒吸,可采取的应急操作是_________________________?;
(6)从E装置所得溶液中取出25.00mL,加两滴酚酞,用0.1000 mol/L的NaOH溶液滴定,当滴定完成后消耗NaOH溶液18.00mL,若实验测得F装置所收集到的气体体积为139.00 mL,则铜和一定量的浓硝酸反应______ (填“有”或“无”)NO生成。
参考答案:(1)增大铜粉与氧气的接触面积,使反应迅速、充分
(2)N2?排出D中的空气?关闭k3,打开k1、k2?
(3)锥形瓶中玻璃管内液面上升
(4)Cu+2NO3—+4H+=Cu2++2NO2↑+2H2O
(5)向下调节量气管(或及时关闭k3)
(6)有
本题解析:本实验目的是证明铜和一定量的浓硝酸反应有一氧化氮产生,而NO与氧气不能共存,故本实验的关键之一就是保证实验装置内无氧气
(1)为了增大铜粉与氧气的接触面积,保证反应迅速充分的进行
(2)从实验装置可看出,空气经NaOH溶液吸收CO2后,再经浓硫酸干燥吸水、铜粉除去氧气,最终进入D中的气体为氮气
EF装置中已经全部充满水,故只需要将E左边的一系列装置内的空气排出即可,故关闭k3,打开k1、k2
(3)C装置的硬质玻璃管中出现堵塞,则B锥形瓶内压强增大,玻璃管内液面将上升
(4)铜与浓硝酸一定有NO2的生成:Cu+2NO3—+4H+=Cu2++2NO2↑+2H2O
(5)出现倒吸主要是由于D中的压强低造成,所以可向下调节量气管;当然更为快捷的方法是及时关闭K3活塞
(6)NO2气体进入E装置中发生反应:3NO2+H2O=2HNO3+NO,E中所得硝酸溶液的浓度为:c×0.025=0.1×0.018,得c=0.072mol/L;
硝酸的物质的量为0.0072mol,同时可得到NO的体积为:0.0072×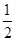 ×22.4=80.64ml
×22.4=80.64ml
而F装置所收集到的气体体积为139.00 mL>80.64ml,故可证明反应过程中有NO的生成
本题难度:一般
4、实验题 (15分)已知硝酸铜溶液呈蓝色。但在铜与浓硝酸、稀硝酸反应的实验中,同学们发现,除了生成的气体颜色不相同外,最终溶液的颜色也不相同:前者呈绿色,而后者呈蓝色。
甲、乙二位同学为此进行了实验探究。
甲:在I、II两支试管中分别加入等体积的浓HNO3和稀HNO3,再向两支试管中分别投入等质量的铜片,充分反应后铜均无剩余。结果:I中溶液呈绿色,II中溶液呈蓝色。
乙:分别取I中的绿色溶液于两支试管Ⅲ、IV中,对试管Ⅲ进行多次振荡、静置,最终溶液颜色由绿色转变为深蓝色;向试管IV中缓缓加水并不停振荡,观察到溶液由绿色变为深蓝色,最后变为淡蓝色。
请回答下列问题:
(1)分别写出Cu与浓HNO3、稀HNO3反应的化学方程式:__________、__________。
(2)甲的实验_______(“能”或“不能”)说明溶液呈现不同的颜色与其物质的量浓度无关,这是因为充分反应后,I、II两试管中Cu(NO3)2溶液的物质的量浓度_______(填“相等”或“不相等”)。
(3)请你根据乙的实验,推测Cu与浓HNO3反应后溶液呈绿色的原因是________
_______________________________________________________________。
(4)请设计一个方案,验证你所得到的上述结论:____________________________。
参考答案:(1)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O(2分)
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O(2分)
(2)能(2分)?相等(2分)
(3)反应产生的NO2部分溶解于浓硝酸中呈黄色,与蓝色的硝酸铜溶液混合而使溶液呈绿色(3分)
(4)方案一:取Cu与浓HNO3反应后的绿色溶液,向其中通入足量的空气(或氧气),溶液颜色由绿色逐渐变为蓝绿色,最终变为蓝色。
方案二:取Cu与浓HNO3反应后的绿色溶液,加热,溶液颜色由绿色逐渐变为蓝绿色,最终变为蓝色(可任选其中一个作答)。(4分)
本题解析:略
本题难度:简单
5、选择题 为同时施用分别含N、P、K三种元素的化肥,对于给定的化肥最适宜的组合是(已知CaHPO4难溶于水)(?)
①K2CO3?②KCl?③Ca(H2PO4)2?④(NH4)2SO4?⑤氨水
A.①②③
B.①③⑤
C.②③④
D.②③⑤
参考答案:C
本题解析:K2CO3溶液、氨水都呈碱性,与Ca(H2PO4)2混合施用时,生成难溶性的Ca3(PO4)2或CaHPO4,难被植物吸收,正确的组合应是②③④。
本题难度:简单