微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 38.4g铜跟适量的浓硝酸反应,铜全部作用后,共收集到气体22.4L(标况)(不考虑N2O4的生成),则反应消耗的硝酸的物质的量是?
A.1.0 mol
B.1.6 mol
C.2.2 mol
D.2.4 mol
参考答案:C
本题解析:略
本题难度:简单
2、实验题 氨气在工农业生产中有重要的用途。某校甲、乙两个化学小组分别对氨的相关实验进行了研究。

(1)甲、乙两小组选择了不同方法制取氨气,
请将实验装置的字母编号和制备原理填写在下表空格中。
?
| 实验装置
| 实验药品
| 制备原理
|
甲小组
| A
| 氢氧化钙、氯化铵
| 反应的化学方程式为
①?
|
乙小组
| ②
| 浓氨水、氢氧化钠
| 用化学平衡原理分析氢氧化钠的作用:
③?
|
?
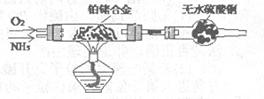
(2)甲组通过右图装置(尾气处理装置已略去)验证了氨有还原性,装置中的实验现象是____?,硬质玻璃管中氨发生催化氧化反应的化学方程式为?。
(3)甲组将足量氨气不断通入滴有酚酞的AgNO3溶液中,现象为?,
反应结束所得溶液中除了H+、OH-、NH4+外还主要含有的离子有?。
(4)乙组欲制备氮化镁,查阅资料发现氨跟氧化铜反应可以制备氮气(2NH3+3CuO 3Cu+N2+3H2O),而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水立即反应生成Mg(OH)2和NH3。乙组提出了如下制备氮化镁的实验方案示意框图(实验前系统内空气已排除;图中箭头表示气体的流向)。你认为此方案是否正确,并说明理由?。
3Cu+N2+3H2O),而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水立即反应生成Mg(OH)2和NH3。乙组提出了如下制备氮化镁的实验方案示意框图(实验前系统内空气已排除;图中箭头表示气体的流向)。你认为此方案是否正确,并说明理由?。
参考答案:(1)① 2NH4Cl+Ca(OH)2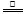 CaCl2+2H2O+2NH3↑。(2分)②B?(1分)
CaCl2+2H2O+2NH3↑。(2分)②B?(1分)
③固体NaOH溶于浓氨水后,放出大量的热,促使NH3的挥发;溶液中OH-浓度的增加,使NH3+H2O NH3·H2O
NH3·H2O NH4+?+OH-向生成NH3的方向移动。(2分)
NH4+?+OH-向生成NH3的方向移动。(2分)
(2)玻璃管中出现红棕色,干燥管中固体变蓝(2分)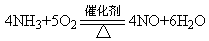 ?(2分)
?(2分)
(3)先产生白色沉淀,后消失;溶液最后变成红色(2分)Ag(NH3)2+、NO3-?(2分)
(4)方案错误;反应产生的NH3全部被H2SO4吸收,不能进行后续反应。(2分)
本题解析:(1)①氢氧化钙、氯化铵制取氨气的化学方程式为2NH4Cl+Ca(OH)2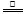 CaCl2+2H2O+2NH3↑
CaCl2+2H2O+2NH3↑
②浓氨水、氢氧化钠制取氨气应选择B装置,
③氨水中存在NH3+H2O NH3·H2O
NH3·H2O NH4+?+OH-的平衡,加入NaOH固体,一是OH-浓度增大,平衡逆向移动;二是NaOH固体溶于水后放出大量的热,促使NH3的挥发;
NH4+?+OH-的平衡,加入NaOH固体,一是OH-浓度增大,平衡逆向移动;二是NaOH固体溶于水后放出大量的热,促使NH3的挥发;
(2)氨气与氧气在催化剂作用下生成一氧化氮气体,该气体遇空气变为红棕色二氧化氮;同时还有水生成,所以无水硫酸铜变蓝色;
(3)甲组将足量氨气不断通入滴有酚酞的AgNO3溶液中,氨气溶于水后,溶液显碱性,与Ag+反应生成氢氧化银沉淀,继续通氨气产生氢氧化二氨合银,沉淀溶解,最终溶液变红色;反应结束所得溶液中除了H+、OH-、NH4+外还主要含有的离子Ag(NH3)2+、NO3-?
(4)不正确,反应产生的氨气全部被浓硫酸吸收,无法进行后面的反应
本题难度:困难
3、选择题 下列说法中正确的有(?)
A.极性分子中一定有极性键
B.非极性分子中一定没有极性键
C.由极性键组成的分子,若为双原子分子,则一定为极性分子
D.不同元素的原子共用电子对时,有的是极性键,有的是非极性键
参考答案:AC
本题解析:键的极性是产生分子极性的前提,但含极性键的分子若电荷分布是对称的,则键产生的极性可以互相抵消,此时,可形成非极性分子;若电荷分布不对称,则键产生的极性不能互相抵消,此时形成极性分子。故A正确,B错误。含极性键的双原子分子电荷一定是不对称分布,必为极性分子。不同元素原子间形成的共用电子对,由于它们吸引电子的能力不同,共用电子对必发生偏移,此时只形成极性键。
本题难度:简单
4、选择题 氨溶于水所得溶液中,除了水分子外,数目最多的微粒是( )
A.NH3
B.NH3·H2O
C.NH
D.OH-
参考答案:B
本题解析:NH3+H2O NH3·H2O
NH3·H2O NH4++OH-,氨气溶于水,部分形成了NH3·H2O,它为弱碱,只有部分电离为NH4++OH-;另外溶液中还存在H2O
NH4++OH-,氨气溶于水,部分形成了NH3·H2O,它为弱碱,只有部分电离为NH4++OH-;另外溶液中还存在H2O H++OH-电离平衡,但很微弱,故氨溶于水所得溶液中,除了水分子外,数目最多的微粒是NH3·H2O
H++OH-电离平衡,但很微弱,故氨溶于水所得溶液中,除了水分子外,数目最多的微粒是NH3·H2O
本题难度:一般
5、选择题 实验室里利用以下反应制取少量氮气:NaNO2+NH4Cl====NaCl+N2↑+2H2O.关于该反应的下列说法正确的是
A.N2既是氧化剂,又是还原剂
B.每生成lmolN2转移的电子的物质的量为6mol
C.NH4Cl中的氮元素被还原
D.NaNO2是氧化剂
参考答案:D
本题解析:A、反应NaNO2+NH4C1═NaC1+N2↑+2H2O中,NaNO2中N的化合价从+3价降为0价,NH4C1中的氮元素化合价从-3价升为0价,氮气既是氧化产物又是还原产物,故A错误;
B、反应NaNO2+NH4C1═NaC1+N2↑+2H2O中,化合价升高值=化合价降低值=转移电子数=3,即每生成1molN2时,转移电子的物质的量为3mol,故B错误;
C、NH4C1中的氮元素化合价从-3价升为0价,所以NH4C1中的氮元素被氧化,故C错误;
D、反应NaNO2+NH4C1═NaC1+N2↑+2H2O中,NaNO2中N的化合价从+3价降为0价,NaNO2是氧化剂,故D正确。
故选D。
点评:氧化还原反应中氧化剂、还原剂的概念以及电子转移知识是重点,考查学生对教材的熟悉程度,难度不大。
本题难度:简单