微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 将一定量铜与足量浓硝酸充分反应,可以得到6.72L NO2气体(气体体积在标准状况下测定)。
(1)写出铜与浓硝酸反应的化学方程式。
(2)若反应后溶液体积为100mL,则所得溶液中Cu2+的物质的量浓度是多少?
(3)若改用排水法收集气体,则可收集到标准状况下的气体的体积为多少?
参考答案:(1)Cu + 4HNO3(浓)? Cu(NO3)2 + 2NO2 ↑+ 2H2O
Cu(NO3)2 + 2NO2 ↑+ 2H2O
(2)1.5mol/L
(3)2.24L
本题解析:
本题难度:一般
2、选择题 将1.12 g铁粉加入25 mL2 mol/L的氯化铁溶液中,充分反应后,其结果是
[? ]
A.铁有剩余,溶液呈浅绿色,Cl-浓度基本不变
B.往溶液中滴入无色KSCN溶液,显血红色
C.Fe2+和Fe3+的物质的量之比为6:1
D.氧化产物与还原产物的物质的量之比为2:5
参考答案:BC
本题解析:
本题难度:一般
3、填空题 将2.5g碳酸钠、碳酸氢钠和氢氧化钠固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:
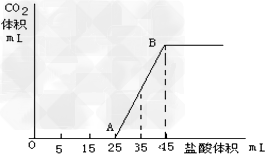
(1)写出OA段所发生反应的离子方程式_______________________?
(2)当加入35mL盐酸时,产生二氧化碳的体积为_______mL(标准状况)
(3)原混合物中Na2CO3的质量分数为_____________。
参考答案:(1)H++OH-=H2O;CO32-+H+=?HCO3-
(2)224
(3)42.4%
本题解析:
本题难度:一般
4、选择题 已知下列物质能氧化H2S,氧化H2S时自身发生下列变化:Fe3+→Fe2+,Cr2O72-→Cr3+,Br2→2Br,HNO3→NO.如要氧化等物质的量的H2S气体得到S单质,需要上述离子或物质的物质的量最大的是
A.Fe3+
B.Cr2O72-
C.Br2
D.HNO3
参考答案:A
本题解析:分析:氧化等物质的量的H2S气体得到S单质,转移电子相等.每摩尔离子或物质获得电子越多,则需要离子或物质的物质的量越少.根据化合价变化判断每摩尔离子或物质获得电子的物质的量.据此判断.
解答:A.Fe3+→Fe2+,1molFe3+获得电子物质的量为1mol;
B.Cr2O72-→Cr3+,1molCr2O72-获得电子物质的量为1mol×2×(6-3)=6mol;
C.Br2→2Br-,1molBr2获得电子物质的量为1mol×2=2mol;
D.HNO3→NO,1molHNO3获得电子物质的量为1mol×(5-2)=3mol.
所以每摩尔离子或物质获得电子为Fe3+<Br2<HNO3<Cr2O72-.所以需Fe3+的物质的量最大.
故选A.
点评:本题考查氧化还原反应计算等,难度中等,熟练掌握电子转移守恒思想的运用即可解答.
本题难度:困难
5、计算题 某原子AZX,它的氯化物XCl 5.85g溶于水制成溶液后,加入2mol/L的AgNO3溶液50mol恰好完全反应。若这种原子原子核内有12个中子,求:
(1)Z值和A值;
(2)X元素在周期表中的位置;
(3)把X的单质放入水中,写出反应的化学方程式。
参考答案:(1)23;11
(2)第三周期,ⅠA族
(3)2Na+2H2O==2NaOH+H2↑
本题解析:
本题难度:一般