微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期, Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质熔点高、硬度大,是一种重要的半导体材料。下列说法中正确的是
[? ]
A.X、M两种元素只能形成X2M型化合物
B.由于W、Z、M元素的氢气化物沸点最低的为M
C.元素Y、Z、W的单质在常温下都为固体
D.元素W和M的某些单质可作为水处理中的消毒剂
参考答案:D
本题解析:
本题难度:一般
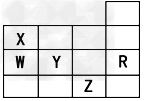
2、选择题 下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中正确的是
[? ]
A.常压下五种元素的单质中Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的沸点比X的氢化物的沸点高
D.Y元素的非金属性比W元素的非金属性强
参考答案:D
本题解析:
本题难度:一般
3、选择题 2007年6月20日,新浪网报道了中国矿业大学发生的铊中毒事件。铊(Tl?)在元素周期表中与铝处于同一主族,与铯(Cs)处于同一周期。下列有关说法中正确的是
[? ]
A.201Tl与204Tl互为同素异形体?
B.20181Tl与20482Pb具有相同的中子数
C.Tl核外有6个电子层?
D.Tl原子半径大于Cs原子半径
参考答案:C
本题解析:
本题难度:简单
4、选择题 下列各种说法中,正确的是
A.元素的性质随着相对原子质量的递增呈周期性变化
B.从Na到Ar,随着原子序数的递增原子半径逐渐变小
C.11号到17号元素化合价的变化,与3号到9号元素化合价的变化完全相同
D.没有元素原子核外电子排布的周期性变化,就没有元素性质的周期性变化
参考答案:D
本题解析:思路解析:元素的性质应是随着原子序数的递增而呈周期性变化,故A选项不正确;原子半径的周期性变化,不包含稀有气体元素的原子,因为稀有气体元素的原子半径的测定与相邻非金属元素的依据不同,其数字不具有可比性,故B选项不正确;11号到17号元素的最高正价从+1递增到+7,而3号到9号元素的最高正价从+1递增到+5,故C选项不正确;由于元素原子核外电子排布的周期性变化,才有原子半径、元素的主要化合价呈周期性变化,故D选项正确.
点评:元素周期律是化学的一般规律,规律都有其例外和特殊的一面.“周期性变化”也不是一成不变地重复,在“周期性”中存在“变化”.我们应该掌握这些特殊点并能辩证地理解规律.
本题难度:困难
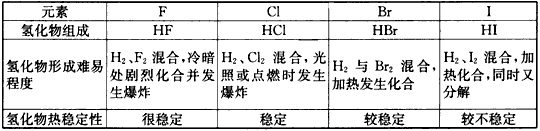
5、选择题 研究下表信息可直接得出的结论是
[? ]
A.元素性质随原子序数的递增而呈周期性变化
B.同周期元素的非金属性随原子序数递增而增强
C.第ⅦA族元素的金属性随电子层数增加而减弱
D.第ⅦA族元素的非金属性随电子层数的增加而减弱
参考答案:D
本题解析:
本题难度:一般