微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (4分)用0.2mol某元素R的单质与足量的盐酸反应,在标准状况下生成6.72L氢气。等量的R元素的单质与足量的氧气化合,可生成10.2gR元素的最高价氧化物,R元素的中子比质子多一个。则R元素为_________(填元素符号),相对原子质量为__________。
参考答案:Al? 27
本题解析:标准状况下6.72L氢气是 ,这说明R的化合价是+3价的所以0.2molR可以生成0.1molR2O3,因此氧化物的相对分子质量是102,所以R的质量数是
,这说明R的化合价是+3价的所以0.2molR可以生成0.1molR2O3,因此氧化物的相对分子质量是102,所以R的质量数是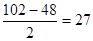 。又因为R元素的中子比质子多一个,所以R的质子数是13,即R是Al。
。又因为R元素的中子比质子多一个,所以R的质子数是13,即R是Al。
本题难度:一般
2、选择题 某短周期主族元素R的最高化合价与负化合价代数和为4。则下列叙述中正确的是
A.R是第ⅣA族元素
B.R能形成两种氧化物RO2和RO3
C.R的气态氢化物的化学式RH4
D.R的气态氢化物的水溶液显强酸性
参考答案:B
本题解析:短周期主族元素R的最高化合价与负化合价代数和为4,即R位于元素周期表中第VIA族元素,第VIA族元素主要化合价有—2、+4、+6价三种价态,能形成氧化物RO2和RO3,
氢化物的化学式为H2R,R的气态氢化物的水溶液显弱酸性,如H2S。
本题难度:一般
3、选择题 已知aA+、bB2+、cC-、dD2-四种离子均具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是
A. 原子半径:A>B>C>D? B. 原子序数:b>a>c>d
C. 离子半径:D>C>B>A? D. 失电子能力:B>A,得电子能力:D>C
参考答案:B
本题解析:略
本题难度:一般
4、填空题 (12分)现有四种系列同族元素形成的物质,它们的沸点(℃,P=1.01×105Pa)如下表所示,
①
| He?-268.8
| Ne?-249.5
| Ar?(x)
| Kr?-151.7
|
②
| F2?-187.0
| Cl2?-33.6
| (a)? 58.7
| I2? 184.0
|
③
| HF?(y)
| HCl?-84.0
| HBr?-67.0
| HI?-35.3
|
④
| H2O?(z)
| H2S?-60.2
| (b)?-42.0
| H2Te?-1.8
|
?试根据上表回答下列问题
(1)a为____________色液体;b的分子式为_______________。
(2)写出②系列中物质主要化学性质的递变规律(任写一种)_______ _____
____________________;能够说明该递变规律的化学事实是_________________________
(任举一例,用离子方程式表示)。
3)除极少数情况外,上述四种系列中物质的沸点与相对分子质量之间均存在一定的关系,该关系是___________________________________________________________________。
(4)上表中,______和______两种物质的沸点较同系 列其它物质反常,反常的主要原因是__
列其它物质反常,反常的主要原因是__
___________________________________________________________________________。
参考答案:
(1)红棕色(1分)? H2Se (1分)
(2)氧化性逐渐减弱(2分)? Cl2+2Br-=2Cl-+Br2(其它合理答案也可)(2分)
(3)随着相对分子质量增大,沸点逐渐升高(2分)
(4)HF、(1分)H2O (1分)它们分子间易形成氢键(2分)
本题解析:略
本题难度:简单
5、选择题 第三能层含有的轨道数为
A.3
B.5
C.7
D.9
参考答案:D
本题解析:考查能级和能层的有关计算和判断。第三能层含有s、p、d3个能级,所以含有的轨道数是1+3+5=9,答案选D。
本题难度:一般