微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 现有几种元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构
T
失去一个电子后,形成Ne原子电子层结构
X
最外层电子数是次外层电子数的2倍
Y
其单质之一是空气中主要成分,最常见的助燃剂
Z
形成双原子单质分子,黄绿色气体
|
(1)元素X的一种同位素用来作原子量标准,这种同位素的符号是______.
(2)画出T的原子结构示意图______.
(3)写出工业上制取单质Z的化学方程式______.
(4)写出由T、Y和Z三种元素组成的一种化合物在水溶液中的电离方程式______.
参考答案:T失去一个电子后,形成Ne原子电子层结构,则T是Na元素;
X最外层电子数是次外层电子数的2倍,则其次外层是第一电子层,所以X是C元素;
Y其单质之一是空气中主要成分,最常见的助燃剂,则Y是O元素;
Z形成双原子单质分子,黄绿色气体,则Z是Cl元素.
(1)元素X的一种同位素C-12用来作原子量标准,这种同位素的符号是612C,故答案为:612C;
(2)钠原子核外有11个电子,则钠的原子结构示意图为
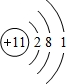
,故答案为:
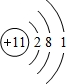
;
(3)工业上用电解饱和氯化钠溶液的方法制取氯气,所以工业上制取氯气的化学方程式为
2NaCl+2H2O?电解?.?Cl2↑+H2↑+2NaOH,故答案为:2NaCl+2H2O?电解?.?Cl2↑+H2↑+2NaOH;
(4)由T、Y和Z三种元素组成的一种化合物为NaClO,次氯酸钠是强电解质,所以其在水溶液中的电离方程式为:
NaClO=Na++ClO-,故答案为:NaClO=Na++ClO-.
本题解析:
本题难度:一般
2、选择题 下列说法中,正确的是( )
A.元素的原子序数越大,其原子半径也越大
B.最外层电子数为8的粒子是稀有气体元素的原子
C.在周期表里,主族元素所在的族序数等于原子核外电子数
D.在周期表里,元素所在的同期数等于该元素原子核外电子层数
参考答案:D
本题解析:
本题难度:一般
3、选择题 核电荷数小于18的某元素X,其原子核外电子层数为a,最外层电子数为(2a+1)。下列有关元素X的说法中,不正确的是?
[? ]
A.元素X的原子核内质子数为(2a2 -1)
B.元素X形成的单质既能作氧化剂又能作还原剂
C.元素X形成的简单离子,各电子层的电子数均达到2n2个(n表示电子层数)
D.由元素X形成的某些化合物,可能具有杀菌消毒的作用
参考答案:C
本题解析:
本题难度:一般
4、选择题 X、Y两元素的原子当它们分别获得1个电子后都能形成稀有气体的电子层结构,且X释放出的能量大于Y,下述不正确的是( )
A.X-还原性大于Y-
B.Y氧化性小于X
C.X原子序数小于Y
D.X-还原性小于Y-
参考答案:A.X、Y两元素的原子获得电子时,X放出的能量大于Y,说明原子得电子能力X>Y,元素的非金属性越强,对应阴离子的还原性越弱,故A错误;
B.元素的非金属性越强,对应单质的氧化性越强,非金属性X>Y,则Y氧化性小于X,故B正确;
C.X、Y两元素的原子当它们分别获得1个电子后都能形成稀有气体的电子层结构,说明二者位于同一主族,同主族元素原子序数越大,非金属性越弱,则X原子序数小于Y,故C正确;
D.非金属性X>Y,元素的非金属性越强,对应阴离子的还原性越弱,则X-还原性小于Y-,故D正确.
故选A.
本题解析:
本题难度:一般
5、简答题 X、Y、Z、W、R是五种短周期元素,其原子序数依次增大.X是周期表中原子半径最小的元素,Y元素原子的最外层电子数是其次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等.请填写下列空白:
(1)画出W的原子结构示意图;______.
(2)Z和W最高价氧化物的水化物的碱性较强的是:______(写化学式),它们之间在溶液中反应的离子方程式是;______;
(3)Z2Y2中阴离子的化学式是______.
(4)在同周期元素中,R?元素及与其相邻元素的原子半径从大到小的顺序是:______.与R元素同周期且非金属性最强的元素是:______.
(5)W的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料,其反应的化学方程式是:______.
参考答案:X、Y、Z、W、R是五种短周期元素,其原子序数依次增大.X是周期表中原子半径最小的元素,则X为氢元素;Y元素原子的最外层电子数是其次外层电子数的3倍,则Y有2个电子层,最外层电子数为6,则Y为氧元素;R与Y处于同一族,则R为硫元素,Z、W、R处于同一周期,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等,则Z、W原子的核外电子数之和为8+16=24,Z、W的原子序数小于R的原子序数,原子序数Z<W,故Z为钠元素,W为铝元素.
故X为氢元素;Y为氧元素;Z为钠元素,W为铝元素,R为硫元素.
(1)W为Al元素,原子核外有13个电子,有3个电子层,最外层有3个电子,原子结构示意图
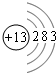
,故答案为:

;
(2)Z为钠元素,W为铝元素,同周期自左而右金属性减弱,所以金属性Na>Al,金属性越强,最高价氧化物的水化物的碱性越强,所以碱性NaOH>Al(OH)3;氢氧化钠与氢氧化铝反应生成偏铝酸钠与氢气,在溶液中反应的离子方程式是?Al(OH)3+OH-=AlO2-+2H2O,
故答案为:NaOH;Al(OH)3+OH-=AlO2-+2H2O;
(3)Z2Y2是Na2O2,阴离子的化学式是O22-,故答案为:O22-;
(4)R为硫元素,在同周期元素中,与S元素相邻元素为P元素、Cl元素,同周期自左而右原子半径减小,所以从大到小的顺序是P>S>Cl.同周期自左而右非金属性增强,所以与S元素同周期且非金属性最强的元素是氯元素,故答案为:P>S>Cl;氯;
(5)Al、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料,为Al2O3、TiC,其反应的化学方程式为4Al+3C+3TiO2?高温?.?2Al2O3+3TiC.
故答案为:4Al+3C+3TiO2?高温?.?2Al2O3+3TiC.
本题解析:
本题难度:一般