微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 欲配制含有大量下列各离子的溶液,能够实现的是
A.Na+、CO32-、OH-、H+
B.Cu2+、Na+、H+、SO42-
C.Mg2+、K+、Cl-、OH-
D.H+、NO3-、Na+、ClO-
参考答案:B
本题解析:分析:离子之间不能结合生成水、气体、沉淀、弱电解质等,不能发生氧化还原反应等,则离子能够共存,即可实现溶液的配制.
解答:A.因OH-、H+能结合生成水,CO32-、H+结合生成水和气体,则不能共存,即不能实现,故A错误;
B.该组离子之间不反应,可实现溶液的配制,故B正确;
C.因Mg2+、OH-能结合生成沉淀,则不能共存,即不能实现,故C错误;
D.因H+、ClO-能结合生成弱电解质,则不能共存,即不能实现,故D错误;
故选B.
点评:本题以溶液的配制来考查离子的共存问题,题目难度不大,熟悉离子的性质及离子之间的反应即可解答.
本题难度:简单
2、选择题 在含FeCl3、FeCl2、AlCl3、NaCl的溶液中,加入足量的氧化钠固体,在空气中充分搅拌后再加过了的稀盐酸,溶液中离子浓度变化最小的是
A.Fe3+
B.Al3+
C.Fe2+
D.Na+
参考答案:B
本题解析:溶液中加入氧化钠后,反应生成氢氧化钠,氢氧化钠与溶液中的物质发生反应,生成氢氧化铁,氢氧化亚铁,偏铝酸钠,接着在空气中搅拌,氢氧化亚铁被氧化成氢氧化铁,最后加入盐酸,氢氧化铁转换成铁离子,亚铁离子消失,铁离子物质的量浓度增加,偏铝酸钠重新转换成铝离子,浓度不发生改变,由于之前加入氧化钠,导致溶液钠离子浓度增大。因此答案选B。
本题难度:简单
3、选择题 在下列各溶液中,离子可能大量共存的是
A.无色溶液中:Al3+、Na+、SO42-、AlO2-
B.澄清透明的溶液中:Cu2+、Fe3+、NO3-、Cl-
C.含有大量ClO-的溶液中:K+、H+、I-、SO32-
D.水电离产生的c(H+)=10-12mol?L-1的溶液中:Na+、Fe2+、SO42-、NO3-
参考答案:B
本题解析:分析:A、利用相互促进水解来分析离子不能共存,Al3+、AlO2-能相互促进水解生成氢氧化铝沉淀;
B、利用离子之间不反应可确定离子能共存;
C、利用氧化还原反应来分析离子不能共存,ClO-、H+、I-发生氧化还原反应,ClO-、H+、SO32-发生氧化还原反应,H+、SO32-能反应生成气体和水,;
D、水电离产生的c(H+)=10-12mol?L-1的溶液,水的电离受到抑制,则可能为酸或碱的溶液,酸溶液中发生氧化还原反应,碱溶液中生成沉淀来分析.
解答:A、因Al3+、AlO2-能相互促进水解生成氢氧化铝沉淀,则不能大量共存,故A错误;
B、因该组离子之间不反应,则能够大量共存,故B正确;
C、因ClO-、H+、I-发生氧化还原反应,ClO-、H+、SO32-发生氧化还原反应,H+、SO32-能反应生成气体和水,则该组离子一定不能大量共存,故C错误;
D、水电离产生的c(H+)=10-12mol?L-1的溶液,水的电离受到抑制,则可能为酸或碱的溶液,酸溶液中Fe2+、NO3-发生氧化还原反应,碱溶液中OH-与Fe2+生成沉淀,则该组离子一定不能共存,故D错误;
故选B.
点评:本题考查离子的共存问题,明确常见离子的性质及离子之间的反应是解答本题的关键.
本题难度:简单
4、选择题 甲、乙是由短周期元素组成的常见物质或微粒,在中学化学中有许多物质或微粒能满足下列相互转化关系: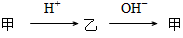 ,下列说法正确的是
,下列说法正确的是
[? ]
A.若乙为无色无味气体,则甲一定是CO32-
B.若甲是具有刺激性气味的气体,则甲、乙具有相同的电子数
C.若甲、乙均为离子,甲、乙两种离子在同一溶液中一定不能大量共存
D.甲有可能是AlO2-也有可能是Al(OH)3
参考答案:BD
本题解析:
本题难度:一般
5、填空题 某待测溶液中可能含有Ag+、Fe3+、Na+、Mg2+、Ba2+、Al3+等离子,进行如下实验:①加入过量的稀盐酸,有白色沉淀生成。②过滤,在滤液中加入过量的稀硫酸,又有白色沉淀。③过滤,取少量滤液,滴入KSCN溶液,没有明显的现象出现。④另取少量步骤③中的滤液,加入NaOH溶液至溶液呈碱性,无明显现象。⑤另取少量步骤④反应后的溶液,焰色反应呈黄色。根据实验现象回答:
(1)待测液中一定含有的离子是?。
(2)待测液中一定不含有的离子是?。
(3)待测液中不能确定是否存在的离子是?,要检测这种离子的实验方法是(填写实验名称和观察到的现象,不要求写实验操作过程)?。
参考答案:(每空2分)?(1)Ag+、Ba2+?(2)Fe3+、Mg2+ 、Al3+?
(3)Na+?取原待测液做焰火反应实验,焰色反应呈黄色,证明待测液中含有Na+
本题解析:加入过量的稀盐酸,有白色沉淀生成,说明溶液中含有Ag+。过滤,在滤液中加入过量的稀硫酸,又有白色沉淀,这说明溶液中还含有Ba2+。过滤,取少量滤液,滴入KSCN溶液,没有明显的现象出现,说明溶液中不存在Fe3+。另取少量步骤③中的滤液,加入NaOH溶液至溶液呈碱性,无明显现象,这说明溶液中没有Mg2+ 、Al3+。另取少量步骤④反应后的溶液,焰色反应呈黄色,说明含有钠离子。但由于在实验过程中加入了氢氧化钠溶液,所以不能确定是否含有钠离子。要检测是否含有钠离子,正确的实验操作是取原待测液做焰火反应实验,焰色反应呈黄色,证明待测液中含有Na+。
点评:该题是中等难度的试题,也是高考中的常见题型,试题综合性强,侧重对学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力。该题还需要注意的是在进行物质的检验时,要依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理、验证即可。
本题难度:一般