微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 现有三种常见治疗胃病药品的标签:

药品中所含的物质均能中和胃里过量的盐酸,下列关于三种药片中和胃酸的能力比较,正确的是( )
A.①=②=③
B.①>②>③
C.③>②>①
D.②>③>①
参考答案:C
本题解析:
本题难度:一般
2、选择题 配制450毫升1mol/L的食盐溶液需选择的容量瓶是( )
A 100ml B 500ml C 450ml D50ml
参考答案:B
本题解析:
正确答案:B
没有450毫升规格的容量瓶,一次配成450毫升溶液,只能选500毫升的容量瓶
本题难度:简单
3、选择题 由CO2、H2、CO组成的混合气在同温同压下与氮气的密度相同,则该混合气中CO2、H2、CO的体积比是( ?)
A.29:8:1
B.21:1:14
C.13:8:29
D.26:6:17
参考答案:C
本题解析:根据阿伏加德罗定律及其推论可知,密度之比是相应的摩尔质量之比,即混合气的平均相对分子质量是28。而氮气的相对分子质量也是28,只要满足CO2和氢气的平均摩尔质量是28g/mol即可。要满足平均相对分子质量是28,则CO2和氢气的体积之比是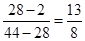 ,所以正确的答案选C。
,所以正确的答案选C。
本题难度:一般
4、选择题 向等体积等物质的量浓度的NaCl、MgCl2两溶液中分别滴加等浓度的AgNO3溶液使Cl-恰好沉 淀完全,则消耗AgNO3溶液的体积之比
淀完全,则消耗AgNO3溶液的体积之比
A.1:1
B.1:2
C.2:1
D.1:3
参考答案:B
本题解析:略
本题难度:一般
5、填空题 当三份铜粉分别与过量的稀硝酸、浓硝酸、热的浓硫酸充分反应后,收集到的气体在相同状况下体积相等时(不考虑NO2转化为N2O4 、生成气体溶解及产生水蒸气的体积),其三份铜的质量比为?
(2)1.28克铜与适量的浓硝酸反应,铜完全溶解,共收集到672 ml NO、NO2混合气(标准状况),则反应中共消耗HNO3的物质的量为?
(3)用20ml 18.4 mol/L浓硫酸和铜共热一段时间后,冷却、过滤,将滤液稀释到100ml,测得溶液中SO42— 的浓度为3.18mol/L,则该溶液CuSO4的物质的量浓度为?
(4)Na2SiO3可以改写成氧化物的形式为Na2O·SiO2,则质量分数为98%的浓硫酸改写成氧化物的形式为?。
参考答案:(11分)(1) 3:1:2?(2)0.07 mol?(3) 0.5 mol/L?(4) SO3·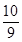 H2O
H2O
本题解析:(1)铜与稀硝酸、浓硝酸和浓硫酸反应的化学方程式分别是3Cu + 8HNO3(稀)=3Cu(NO3)2 + 2NO↑+ 4H2O、Cu + 4HNO3(浓) Cu(NO3)2 + 2NO2↑+ 2H2O、Cu+2H2SO4(浓)
Cu(NO3)2 + 2NO2↑+ 2H2O、Cu+2H2SO4(浓)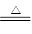 CuSO4+2H2O+SO2↑。当反应中生成当气体体积相等时(假设均是2mol),则根据方程式可知,消耗铜的质量之比是3:1:2。
CuSO4+2H2O+SO2↑。当反应中生成当气体体积相等时(假设均是2mol),则根据方程式可知,消耗铜的质量之比是3:1:2。
(2)1.28g铜的物质的量是1.28g÷64g/mol=0.02mol,则生成硝酸铜就是0.02mol。672 ml NO、NO2混合气(标准状况)的物质的量是0.672L÷22.4L/mol=0.03mol,实验根据氮原子守恒可知,参加反应的硝酸的物质的量是0.02mol×2+0.03mol=0.07mol。
(3)反应前浓硫酸的物质的量是0.02L×18.4mol/L=0.368mol,反应后溶液中SO42-的物质的量是0.10L×3.18mol/L=0.3186mol,则根据S原子守恒可知,反应中生成SO2的物质的量是0.368mol-0.318mol=0.05mol,所以根据电子得失守恒可知,参加反应的铜的物质的量是0.05mol,则硫酸铜的物质的量是0.05mol,其浓度是0.05mol÷0.1L=0.5mol/。
(4)98%的浓硫酸中硫酸和水的物质的量之比是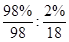 =9:1,由于硫酸可以看作是SO3·H2O,所以98%的浓硫酸改写成氧化物的形式为SO3·
=9:1,由于硫酸可以看作是SO3·H2O,所以98%的浓硫酸改写成氧化物的形式为SO3·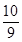 H2O。
H2O。
点评:该题是中等难度的试题,试题基础性强,难易适中,注重解题的灵活性,有利于培养学生的逻辑推理能力和发散思维能力。明确反应的原理并能依据守恒法答题是关键。守恒法是计算题中最常用也是最重要的解题方法,常见守恒法有质量守恒、原子守恒、电荷守恒、电子的得失守恒等,需要平时学习中注意积累和总结。
本题难度:一般