|
高考化学必考知识点《化学反应与能量》在线测试(2017年最新版)(十)
2017-07-27 10:56:41
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知:C(s)+O2(g)=CO2(g) △H1
CO2(g)+C(s)=2CO(g) △H2
2CO(g)+O2(g)=2CO2(g) △H3
4Fe(s)+3O2 (g)=2Fe2O3(s) △H4
3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是
A.△H1=△H2+△H3
B.△H2>0,△H4>0
C.△H1>0,△H3<0
D.△H3=△H4+△H5
|
参考答案:A
本题解析:C(s)+O2(g)=CO2(g) 是由CO2(g)+C(s)=2CO(g)和2CO(g)+O2(g)=2CO2(g)的方程式叠加而来,所以依据盖斯定律,△H1=△H2+△H3故A项正确;大部分的反应均是放热反应而4Fe(s)+3O2 (g)=2Fe2O3(s)既是化合反应也是氧化反应,故该反应放热,△H4<0,C(s)+O2(g)=CO2(g) 为碳的燃烧反应,△H1<0,根据盖斯定律(4Fe(s)+3O2 (g)=2Fe2O3(s) )× +3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) 为2CO(g)+O2(g)=2CO2(g) 所以△H3= +3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) 为2CO(g)+O2(g)=2CO2(g) 所以△H3= △H4+△H5,综上所述,B、C、D均错误,故选择A △H4+△H5,综上所述,B、C、D均错误,故选择A
考点:焓变 盖斯定律
点评:盖斯定律属于高考的必考内容,连续这几年都在考查,需要大家熟练掌握。同学们可以熟记以下口诀:“同向同号 反向变号 乘除调倍 多余干掉”。
本题难度:一般
2、选择题 下列变化中,必须加入还原剂才能实现的是
A.MnO2→Mn2+
B.Zn→Zn2+
C.H2→H2O
D.CuO→CuCl2
参考答案:A
本题解析:分析:必须加入还原剂才能实现氧化还原反应,说明该物质作氧化剂,得电子化合价降低,据此分析解答.
解答:A、MnO2→Mn2+中锰元素得电子化合价降低,所以二氧化锰作氧化剂,必须加入还原剂才能实现,故A正确.
B、Zn→Zn2+中锌失电子化合价升高,所以锌作还原剂,必须加入氧化剂才能实现,故B错误.
C、H2→H2O中氢元素失电子化合价升高,所以氢气作还原剂,必须加入氧化剂才能实现,故C错误.
D、CuO→CuCl2中铜元素化合价不变,所以不是氧化还原反应,故D错误.
故选A.
点评:本题考查氧化还原反应,明确元素的化合价降低时物质被还原、元素的化合价升高时被氧化是解答本题的关键,难度不大.
本题难度:简单
3、填空题 (5分)丙烷燃烧可以通过以下两种途径:
途径I:C3H8(g) + 5O2(g) ="=" 3CO2(g) +4H2O(l)? ΔH=-a kJ·mol-1
途径II:C3H8(g) ==C3H6(g)+ H2(g)? ΔH=+b kJ·mol-1 H2(g)? ΔH=+b kJ·mol-1
2C3H6(g)+ 9O2(g) ="=" 6CO2(g) +6H2O(l)?ΔH=-c kJ·mol-1
2H2(g)+O2 (g) ==?2H2O(l)?ΔH=-d kJ·mol-1(abcd均为正值)
请回答下列问题:
(1)判断等量的丙烷通过两种途径放出的热量,途径I放出的热量?______(填“大于”、“等于”或“小于”)途径II放出的热量
(2)由于C3H8(g) ==C3H6(g)+ H2(g) 的反应中,反应物具有的总能量______(填“大于”、“等于”或“小于”)生成物具有的总能量,那么在化学反应时。反应物就需要______(填“放出”、或“吸收”)能量才能转化为生成物,因此其反应条件是______________
(3)b 与a、c、d的数学关系式是______________
参考答案:
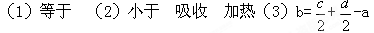
本题解析:略
本题难度:一般
4、选择题 两种无色溶液混合后仍然为无色透明溶液,混合后的溶液中可能存在的离子组合为
A.Mg2+、、K+、Cl-
B.Na+、、、Fe3+
C.K+、Cu2+、Cl-、Br-
D.Ba2+、Na+、OH-、
参考答案:A
本题解析:分析:根据离子之间不能结合生成水、气体、沉淀、弱电解质等,则离子能大量共存,并结合离子的颜色来解答.
解答:A.该组离子之间不反应,能共存,且均为无色,故A正确;
B.该组离子之间不反应,能共存,但Fe3+为黄色,与无色溶液不符,故B错误;
C.该组离子之间不反应,能共存,但Cu2+为蓝色,与无色溶液不符,故C错误;
D.Ba2+、SO42-结合生成沉淀,则不能共存,故D错误;
故选A.
点评:本题考查离子的共存,侧重复分解反应发生的条件及离子的颜色的考查,注重基础知识的训练,题目较简单.
本题难度:一般
5、选择题 在一定条件下,将1 mol的CO和水蒸气通入容器中发生下述反应:CO+H2O CO2+H2,达到平衡后,测得CO2为0.6 mol,再通入4 mol水蒸气,又达到平衡后,CO2的物质的量(? ) CO2+H2,达到平衡后,测得CO2为0.6 mol,再通入4 mol水蒸气,又达到平衡后,CO2的物质的量(? )
A.等于0.6 mol
B.等于1 mol
C.大于0.6 mol小于1 mol
D.大于1 mol
参考答案:C
本题解析:本题考查了反应的可逆性及化学平衡的移动。增大反应物浓度,平衡向正反应方向移动,故CO2的物质的量一定大于0.6 mol,但1 mol CO完全转化也只能生成1 mol CO2,所以CO2物质的量小于1 mol,故选C
本题难度:一般
|