|
高中化学知识点大全《物质的分离、提纯》考点巩固(2017年最新版)(二)
2017-07-27 10:59:56
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 市售乙醛通常为40%左右的乙醛溶液。久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液。据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基。乙醛在溶液中易被氧化,为了从变质的乙醛溶液中提取乙醛(仍得溶液),可利用如下原理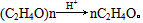
思考下列问题并填空
(1)先把混合物分离得到(C2H4O)n。将混合物放入________中,静置,分离操作名称为________。
(2)证明是否已有部分乙醛被氧化的实验操作和现象是 ____________________________________。
(3)将少量乙醛滴入浓硫酸中,生成黑色物质,反应方程式为 __________________________。
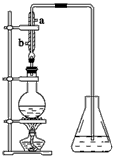
(4)提取乙醛的装置如上图所示,烧瓶中是(C2H4O)n和6mol·L-1H2SO4混合液,锥形瓶中是蒸馏水。加热至混合液沸腾。(C2H4O)n缓慢分解,生成气体导入锥形瓶内的水中。
①用冷凝管的目的是______________________,冷凝水的进口是________(填“a”或“b”)。
②锥形瓶内导管口出现气泡从下上升到液面过程中,体积越来越小,直至完全消失,说明乙醛具有
________的性质。当观察到导气管中气流很小时,必要的操作是________,目的是______________。
③若n=3,则(C2H4O)n的结构简式为____________________________。
参考答案:(1)分液漏斗;分液
(2)取少量下层水溶液,滴加石蕊试液,如果溶液呈红色,说明部分乙醛被氧化(即检验乙酸是否存在)
(3)CH3CHO+H2SO4(浓)→2C↓+SO2↑+3H2O
(4)①使水蒸气冷凝,防止H2SO4浓度变大,以免乙醛被氧化;b
②易溶于水;及时撤去导 气管;防止发生倒吸 ③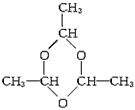
本题解析:
本题难度:一般
2、填空题 (8分)
在下表中填入除去各粉末状混合物中的杂质(括号内为杂质)所用的试剂。将所选试剂的代号填入表内“试剂”栏相应的空格内。
可供选择的试剂:
A.盐酸,
B.氢氧化钠溶液,
C.氧气,
D.水,E.二氧化碳
| 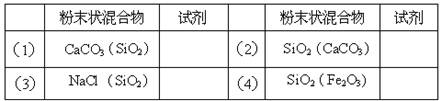
参考答案:(1)B(2分)?(2)A(2分)?(3)D(2分)?(4)A(2分)
本题解析:
(1) 氢氧化钠与二氧化硅发生反应:SiO2+2NaOH ="=" Na2SiO3+H2O,氢氧化钠与碳酸钙不反应,反应后过滤、洗涤、干燥后即可分离。故氢氧化钠可除去碳酸钙中的二氧化硅杂质。
(2) 盐酸和碳酸钙发生反应:CaCO3+2HCl=CaCl2+CO2↑+H2O,盐酸和二氧化硅不反应,反应后过滤、洗涤、干燥后即可分离。故盐酸可除去二氧化硅中的碳酸钙杂质。
(3)氯化钠溶于水,二氧化硅不能。故可用水溶解混合物,过滤,把滤液进行蒸发结晶即可。故水可分离氯化钠和二氧化硅的混合物。
(4)盐酸和氧化铁发生反应:6HCl+2Fe2O3==2FeCl3+3H2O,盐酸和二氧化硅不反应,反应后过滤、洗涤、干燥后即可分离。故盐酸可除去二氧化硅中的氧化铁。
本题难度:一般
3、选择题 实验用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历下列过程,Fe3+在pH=5时已完全沉淀,其中分析错误的是
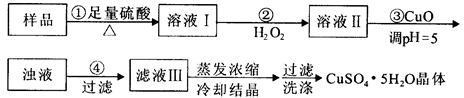
A.利用CuCO3替代CuO也可调节溶液的pH,不影响实验结果
B.步骤②中发生的主要反应为:H2O2+Fe2++2H+=Fe3++2H2O
C.洗涤晶体:向滤出晶体的漏斗中加少量水至浸没晶体,待自然流下后,重复2~3次
D.配制240 mL1mol/L的CuSO4溶液,需称量CuSO4·5H2O的质量为62.5g
参考答案:B
本题解析:A、CuCO3和CuO都与溶液中H+反应,起到调节溶液pH的作用,并不引入新的杂质,故A正确; B、双氧水具有氧化性,能把溶液中的亚铁离子氧化生成铁离子,因此步骤②中发生的主要反应为:H2O2+2Fe2++2H+=2Fe3++2H2O,B不正确;C、固体具有吸附性,过滤时表面有可溶性物质,可向滤出晶体的漏斗中加少量水浸没晶体,自然流下,重复2-3次,可洗涤晶体,故C正确;D、实验室没有240ml容量瓶,所以配制240 mL1mol/L的CuSO4溶液,需要250ml容量瓶,因此需称量CuSO4·5H2O的质量为0.25L×1mol/L×250g/mol=62.5g,故D正确,答案选B。
本题难度:一般
4、实验题 草酸亚铁晶体(FeC2O4·2H2O)呈淡黄色。某课题组为探究草酸业铁晶体的化学性质,?进行了一系列实验探究。
(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到二氧化碳气体生成。这说明草酸亚铁晶体具有?(填“氧化性”、“还原性”或“碱性”)。若反应中消耗1 mol FeC2O4·2H2O,则参加反应的KMnO4为?mol。
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体。课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三:
假设一:全部是FeO
假设二:?
假设三:?
(3)为验证上述假设一是否成立,课题组进行如下研究。
【定性研究】请你完成下表中内容。
实验步骤(不要求写出具体操作过程)
| 预期实验现象和结论
| 取少量黑色固体,?
?
?
| ?
?
?
|
?
【定量研究】课题组在文献中查阅到,FeC2O4·2H2O受热分解时,固体质量随温度变化的曲线如下图所示,写出加热到400℃时,FeC2O4·2H2O晶体受热分解的化学方程式为:?。

根据图象,如有1.0 g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4 g。某同学由此得出结论:假设一不成立。你是否同意该同学的结论,并简述理由:
?
参考答案:(共1 5分)
(1)还原性(1分) ?0.6(2分)
(2)假设二:全部是Fe3O4(1分)?假设三:是FeO和Fe3O4的混合物(1分)
(3)【定性研究】(每空2分)
实验步骤:取少量黑色固体,加入适量稀盐酸(或稀硫酸)溶解,在溶液中加入KSCN溶液
预期实验现象和结论:若溶液不变红色,则假设一成立;若溶液变红色,则假设一不成立
【定量研究】
FeC2O4·2H2OFeO+CO↑+CO2↑+2H2O(或FeC2O4FeO+CO↑+CO2↑,3分)
不同意(1分),实验未在密闭容器中进行,FeO会被空气中的氧气进一步氧化,生成铁的其他氧化物(2分)
本题解析:
(1)高锰酸钾溶液的紫红色褪去,溶液变为棕黄色,很显然是FeC2O4被高锰酸钾氧化为Fe3+的结果,表明FeC2O4具有还原性。分析有关元素化合价的变化可知,反应过程中1 mol FeC2O4·2H2O可失去3 mol电子,而l mol KMnO4可得到5 mol电子:根据得失电子数相等的原则,反应中FeC2O4·2H2O与KMnO4的物质的量之比为5:3。因此,若反应中消耗1 mol FeC2O4·2H2O,则参加反应的KMnO4为3/5 mol。
(2)铁的氧化物中,呈黑色的有FeO和Fe3O4。
(3)【定性研究】FeO与盐酸或硫酸反应生成Fe2+,Fe2+与KSCN不反应。但Fe3O4或FeO和Fe3O4的混合物溶于稀盐酸或稀硫酸中生成Fe3+,遇KSCN变红色。据此即可设计方案进行验证。
【定量研究】草酸亚铁品体受热首先失去结品水,得到FeC2O4(即A点对应物质)。400℃时固体质量减少,应该是FeC2O4发生分解,牛成铁的氧化物(即B点对应物质)。根据图象可知1.0 g晶体分解生成的铁的氧化物的质量为0.4 g。设此铁的氧化物的化学式为FeaOb,根据Fe守恒可知0.4 g此氧化物中铁元素的质量为1.0 g×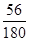 ,氧元素的质量为(0.4g—1.0 g× ,氧元素的质量为(0.4g—1.0 g×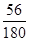 )g,故a:b="(1.0" g× )g,故a:b="(1.0" g×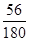 ):(0.4g—1.0 g× ):(0.4g—1.0 g×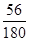 ),解得a:b=1:1,即晶体分解所得铁的氧化物为FeO。至此不难写出草酸亚铁晶体分解的化学方程式为:FeC2O4·2H2OFeO+CO↑+CO2↑+2H2O(或FeC2O4FeO+CO↑+CO2↑)。此后,残留固体的质量逐渐增大,显然是被空气中的氧气所氧化,生成了铁的其他氧化物。由于坩埚是敞口容器,FeO会被空气中的氧气进一步氧化生成铁的其他氧化物,根据图象可知固体质量肯定会大于4.0 g。 ),解得a:b=1:1,即晶体分解所得铁的氧化物为FeO。至此不难写出草酸亚铁晶体分解的化学方程式为:FeC2O4·2H2OFeO+CO↑+CO2↑+2H2O(或FeC2O4FeO+CO↑+CO2↑)。此后,残留固体的质量逐渐增大,显然是被空气中的氧气所氧化,生成了铁的其他氧化物。由于坩埚是敞口容器,FeO会被空气中的氧气进一步氧化生成铁的其他氧化物,根据图象可知固体质量肯定会大于4.0 g。
本题难度:一般
5、填空题 (1)下列A、B、C、D是中学常见的混合物分离或提纯的基本装置.
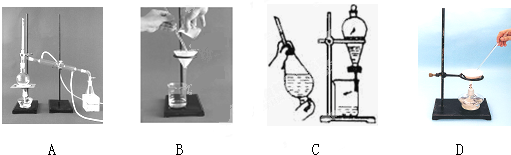
根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置(将A、B、C、D填入适当的空格中).
?①除去Ca(OH)2溶液中悬浮的CaCO3______;
②从碘水中提取碘______;
③用自来水制取蒸馏水______;
④分离植物油和水______;
⑤除去食盐水中的泥沙______;
⑥与海水晒盐原理相符的是______.
(2)由可溶性铝盐制取氢氧化铝,需加入的试剂为:______;离子方程式为:______.
白色的Fe(OH)2在空气中发生的颜色变化为______.反应的化学方程式为:______.
参考答案:(1)①除去Ca(OH)2溶液中悬浮的CaCO3应用过滤的方法分离;
②从碘水中提取碘可用萃取、分液的方法分离;
③用自来水制取蒸馏水可用蒸馏的方法;
④分离植物油和水可用分液的方法;
⑤除去食盐水中的泥沙可用过滤的方法;
⑥与海水晒盐原理相符的是蒸发,
故答案为:①B;②C;③A;④C;⑤B;⑥D;
(2)氢氧化铝为两性物质,可与强碱反应,制备时应用弱碱,可在铝盐中加入氨水,反应的离子方程式为
Al3++3NH3?H2O=Al(OH)3↓+3NH4+,白色的Fe(OH)2在空气中发生反应生成红褐色的氢氧化铁,现象是白色迅速变为灰绿色最终变为红褐色,反应的方程式为4Fe(OH)2+2H2O+O2═4Fe(OH)3,
故答案为:氨水(或稀氨水);Al3++3NH3?H2O=Al(OH)3↓+3NH4+;白色迅速变为灰绿色最终变为红褐色;4Fe(OH)2+2H2O+O2═4Fe(OH)3.
本题解析:
本题难度:一般
| 
