微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 两瓶均为棕黄色的氯化铁溶液和溴水,用下列试剂无法鉴别的是( )
A.KSCN
B.CCl4
C.NaOH
D.淀粉KI试纸
参考答案:D
本题解析:A:氯化铁溶液与KSCN生成血红色络合物,可以鉴别
B:均出现分层现象,但溴水中的溴可被CCl4萃取,有机层呈现棕红色,可以鉴别
C:氯化铁与碱液生成红褐色沉淀,而溴水将褪色,可以鉴别
D:均可使试纸呈蓝色,不能鉴别,符合题意
答案为D
本题难度:简单
2、选择题 化学工作者从有机反应:RH+Cl2(g) RCl(l)+HCl(g)受到启发,提出的在农药和有机合成工业中可获得副产品盐酸的设想已成为现实。从上述反应产物中分离出盐酸的最佳方法是
RCl(l)+HCl(g)受到启发,提出的在农药和有机合成工业中可获得副产品盐酸的设想已成为现实。从上述反应产物中分离出盐酸的最佳方法是
(g表示物质为气态,l表示物质为液态)
[? ]
A.蒸馏法
B.水洗分液法
C.升华法
D.有机溶剂萃取法
参考答案:B
本题解析:
本题难度:简单
3、填空题 由软锰矿制备高锰酸钾的主要反应如下:
熔融氧化? 3MnO2+KClO3+6KOH 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
加酸歧化? 3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度(293K)见下表:
?
| K2CO3
| KHCO3
| K2SO4
| KMnO4
|
溶解度/g
| 111
| 33.7
| 11.1
| 6.34
|
(1)在实验室进行“熔融氧化”操作时,应选用铁棒、坩埚钳和?。(填字母)
a.表面皿? b.蒸发皿? c.铁坩埚? d.泥三角
(2)加酸时不宜用硫酸的原因是?;不宜用盐酸的原因是?。
(3)采用电解法也可以实现K2MnO4的转化,2K2MnO4+2H2O 2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为?。
2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为?。
(4)草酸钠滴定法分析高锰酸钾纯度步骤如下:
Ⅰ 称取0.80 g左右的高锰酸钾产品,配成50 mL溶液。
Ⅱ 准确称取0.2014 g左右已烘干的Na2C2O4,置于锥形瓶中,加入少量蒸馏水使其溶解,再加入少量硫酸酸化。
Ⅲ 将瓶中溶液加热到75~80 ℃,趁热用Ⅰ中配制的高锰酸钾溶液滴定至终点。记录消耗高锰酸钾溶液的体积,计算得出产品纯度。
①滴定过程中反应的离子方程式为?。
②达到滴定终点的标志为?。
③加热温度大于90℃,部分草酸发生分解,会导致测得产品纯度?。(填“偏高”、“偏低”或“无影响”)?
④将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如图,其原因可能为?。
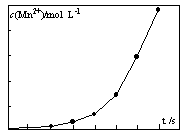
参考答案:(1)c d(2)生成K2SO4溶解度小,会降低产品的纯度。盐酸具有还原性,会被氧化,降低产品的量。(3)K2MnO4中的锰元素可以完全转化到KMnO4中,提高利用率。(4)①2MnO4―+5C2O42?―+16H+=2Mn2++10CO2↑+8H2O 或MnO4―+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O②锥形瓶中溶液突变为浅红色且半分钟内不褪色。③偏高(1分)④生成的Mn2+作催化剂,随着Mn2+浓度增加,反应速率越来越快。
本题解析:(1)进行“熔融氧化”操作时,应选用铁棒、坩埚钳和 c.铁坩埚和d.泥三角。(2)根据表中的数据K2CO3的溶解度是K2SO4的10倍,加酸时生成K2SO4溶解度小,不利于平衡右移,会降低产品的纯度。另外盐酸具有还原性,会被高锰酸钾氧化,降低产品的量。(3)与原方法相比,电解法的优势为K2MnO4中的锰元素可以完全转化到KMnO4中,提高利用率。①C2O42?―有还原性被高锰酸钾氧化为二氧化碳,在酸性溶液中高锰酸钾的还原产物是二价锰离子,滴定过程中反应的离子方程式为①2MnO4―+5C2O42?―+16H+=2Mn2++10CO2↑+8H2O 或MnO4―+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。②由于高锰酸根是紫色溶液,可以通过本身颜色的变化做为终点判断,锥形瓶中一开始是无色溶液,达到滴定终点的标志为锥形瓶中溶液突变为浅红色且半分钟内不褪色。③由于草酸发生了分解,浓度自然减小,测定中用量肯定会增多,计算出高锰酸钾的量增大,会导致测得产品纯度偏高。④从图像中可以看出锰离子的浓度到后来增加程度较大,其原因可能为生成的Mn2+作催化剂,随着Mn2+浓度增加,反应速率越来越快。
本题难度:一般
4、选择题 鉴别NaHCO3溶液和Na2CO3溶液,下列实验方案正确的是(?)
A.用NaOH溶液
B.用加热的方法
C.用澄清石灰水
D.用BaCl2溶液或CaCl2溶液
参考答案:D
本题解析:结合NaHCO3溶液和Na2CO3溶液的化学性质知:A项中没有明显的现象;B项由于所鉴别的是溶液,加热时溶液不会分解;C项中均有白色沉淀;D项中用BaCl2溶液或CaCl2溶液,NaHCO3溶液中没有明显现象,Na2CO3溶液中有白色沉淀产生。
本题难度:简单
5、填空题 【10分】取少量Fe2O3粉末(红棕色)加入适量盐酸,所发生反应的化学方程式为___________,
反应后得到的FeCl3溶液呈棕黄色。用此溶液进行以下实验:
(1)取少量溶液置于试管中,滴入NaOH溶液,可观察到有红褐色沉淀生成,反应的化学方程式为__________________,此反应属于_________反应。
(2)在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴FeCl3溶液,继续煮沸至溶液呈_________色,即可制得Fe(OH)3胶体。
(3)取另一小烧杯也加入20 mL蒸馏水后,向烧杯中加入1 mL FeCl3溶液,振荡均匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置暗处:分别用激光笔照射烧杯中的液体,可以看到_________烧杯中的液体会产生丁达尔效应。这个实验可用来区别_________。
(4)取乙烧杯中少量Fe(OH)3胶体置于试管中,向试管中滴加一定量稀盐酸,边滴边振荡,可看到溶液红褐色逐渐变浅,最终又得到黄色的FeCl3溶液,发生此变化的化学方程式为____
_________________________,此反应也属于________________反应。
参考答案:Fe2O3+6HCl====2FeCl3+3H2O
(1)FeCl3+3NaOH====Fe(OH)3↓+3NaCl?复分解
(2)红褐? (3)乙?胶体和溶液
(4)Fe(OH)3+3HCl====FeCl3+3H2O复分解
本题解析:本题考查Fe(OH)3胶体的制备及性质。
Fe2O3粉末(红棕色)加入适量盐酸,反应的化学方程式为:Fe2O3+6HCl=2FeCl3+3H2O
(1)?在FeCl3溶液滴入NaOH溶液,反应的化学方程式为:FeCl3+3NaOH=Fe(OH)3↓+3NaCl?
此反应属于复分解反应
(2)?溶液呈红褐色,这是Fe(OH)3胶体的颜色
(3)?可以看到乙烧杯中的液体会产生丁达尔效应,这个实验可用来区别胶体和溶液
(4)?此变化的化学方程式为:Fe(OH)3+3HCl=FeCl3+3H2O?此反应也属于复分解反应。
本题难度:简单