微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 实验室需要500ml?0.4mol?L-1的NaOH溶液,配制时:
(1)需称量______g的烧碱固体,固体应放在______中置于天平的左盘称量.
(2)配制过程中,下列仪器中肯定不需要使用的是______.
(3)根据实验的实际需要和(2)中列出的仪器判断,完成实验还缺少的仪器是(填仪器名称)______.
(4)若实验时遇到下列情况,所配溶液的浓度偏大的是______.
A.加水定容时超过刻度线,又吸出少量水至刻度线
B.忘记将洗涤液转入容量瓶
C.容量瓶洗涤后内壁有水珠而未作干燥处理
D.溶液未冷却即转入容量瓶
E.定容时俯视刻度线.
参考答案:(1)需氢氧化钠的质量为m=0.5L×0.4mol?L-1×40g/mol=8.0g.
氢氧化钠有腐蚀性,易潮解,应放在小烧杯内迅速称量.
故答案为:8.0;小烧杯.
(2)操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.
所以需要的仪器有天平、烧杯、玻璃棒、500mL容量瓶、胶头滴管、药匙.
根据给出的仪器可知肯定不需要使用的是圆底烧瓶、分液漏斗.
故选:AC.
(3)由(2)可知还需要的仪器为天平、烧杯、玻璃棒、药匙.
故答案为:天平、烧杯、玻璃棒、药匙
(4)A.定容时,加水超过刻度线,使溶液的体积偏大,所配溶液浓度偏低,溶液是均匀的,再用胶头滴管吸出多余的部分,剩余溶液与所配溶液浓度相同,溶液浓度偏低;
B.未将洗涤液转入容量瓶,移入容量瓶中氢氧化钠的实际质量减小,溶液浓度偏低;
C.最后需要定容,容量瓶不干燥,含有少量蒸馏水,对溶液浓度无影响;
D.液体具有热胀冷缩的性质,氢氧化钠溶解放热,未冷却到室温,趁热将溶液到入容量瓶,并配成溶液,会导致溶液体积偏小,溶液浓度偏大;
E.定容时,俯视容量瓶刻度线,使溶液的体积偏低,所以溶液浓度偏大.
故选:DE
本题解析:
本题难度:一般
2、选择题 下列溶液中Cl-的物质的量浓度最大的是( )
A.50mL0.5mol/LAlCl3溶液
B.100mL0.5mol/LMgCl2溶液
C.100mL1mol/LNaCl溶液
D.50mL0.5mol/LHCl溶液
参考答案:A、50mL 0.5mol/L AlCl3溶液中C(Cl-)=3C(AlCl3)=0.5mol/L×3=1.5mol/L;
B、100mL 0.5mol/L MgCl2溶液中C(Cl-)=2C(MgCl2)=0.5mol/L×2=1mol/L;
C、100mL1mol/L NaCl溶液中C(Cl-)=C(NaCl)=1mol/L;
D、50mL0.5mol/L HCl溶液中C(Cl-)=C(HCl)=0.5mol/L;
所以氯离子浓度最大的是1.5mol/L;
故选:A.
本题解析:
本题难度:简单
3、选择题 下列溶液中Cl-物质的量浓度最大的是
[? ]
A.10 mL 0.1 mol/L的AlCl3溶液
B.20 mL 0.1 mol/L的CaCl2溶液
C.30 mL 0.2 mol/L的KCl溶液
D.100 mL 0.25 mol/L的NaCl溶液
参考答案:A
本题解析:
本题难度:简单
4、实验题 用固体NaOH配制250 mL 0.5 mol·L-1 NaOH溶液;
(1)在下列仪器中:①托盘天平(带砝码);②量筒;③烧杯;④玻璃棒;⑤漏斗;⑥500 mL容量瓶;⑦药匙;⑧250 mL容量瓶;⑨胶头滴管;⑩坩埚。
A.配制过程中必须用到的仪器有:_________________(填写代号)。
B.容量瓶使用前应__________,中学化学实验常用仪器中使用前和容量瓶使用有相同操作的不同类玻璃仪器还有:________、________;
(2)下列操作使所配制的NaOH溶液浓度偏高的有:________(填写代号)。
①称取固体NaOH时未用小烧杯
②没有用水冲洗烧杯2~3次
③定容时,俯视液面使之与刻度相切
④溶液配好摇匀后,发现液面低于刻度线,又加水至液面与刻度相切
⑤将未冷却的溶液注入容量瓶后,马上定容
⑥样品中混有Na2O杂质
参考答案:(1)A.①②③④⑦⑧⑨;B.检查是否漏水;滴定管;分液漏斗
(2)③⑤⑥
本题解析:
本题难度:一般
5、实验题 实验室中有一未知浓度的稀盐酸,某同学测定盐酸的浓度在实验室中进行实验。请完成下列填空:
(1)配制100 mL 0.10 mol·L-1NaOH标准溶液。
①主要操作步骤:计算→称量→溶解→(冷却后)→洗涤(并将洗涤液移入容量瓶)→__________→__________→__________→将配制好的溶液倒入试剂瓶中,贴上标签。
②称量__________g氢氧化钠固体所需仪器有:天平(带砝码、镊子)、__________、__________。
(2)取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
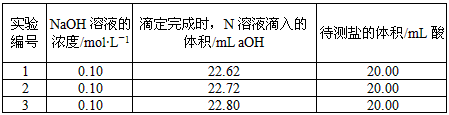
①滴定达到终点的标志是__________________。
②根据上述数据,可计算出该盐酸的浓度约为__________(保留两位有效数字)。
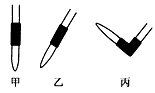
③排去碱式滴定管中气泡的方法应采用如图所示操作中的__________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有__________。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸、润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失
参考答案:(1)①转移;定容;摇匀;②0.4;烧杯(或表面皿);药匙
(2)①最后一滴NaOH溶液加入,溶液由无色恰好变成浅粉红色,且半分钟内不褪色;②0.11 mol·L-1;
③丙;④D
本题解析:
本题难度:一般