微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,AgCl、AgBr、AgI的溶度积依次为1.5×10-12、5.0×10-15、8.3×10-16,下列有关说法错误的是( )
A.常温下在水中溶解能力AgCl>AgBr>AgI
B.在AgCl饱和液中加入足量浓NaBr溶液有AgBr沉淀生成
C.在AgBr饱和溶液中加入足量浓NaCl溶液不可能有AgCl沉淀生成
D.在AgI饱和液中加入NaI固体有AgI沉淀析出
参考答案:A、根据化学式相似的物质的溶度积常数越小,物质越难溶可知常温下在水中溶解能力AgCl>AgBr>AgI,故A正确;
B、AgBr比AgCl更难溶,在AgCl饱和溶液中加入足量浓NaBr溶液可生成AgBr沉淀,故B正确;
C、在AgBr饱和溶液中加入足量浓NaCl溶液,当溶液中c(Ag+)×c(Cl-)>1.8×10-10mol2?L-2,有AgCl沉淀生成,故C错误;
D、在AgI饱和溶液中加入NaI固体,I-离子浓度增大,c(Ag+)×c(I-)>8.3×10-17mol2?L-2,有AgI沉淀析出,故D正确.
故选C.
本题解析:
本题难度:一般
2、选择题 要使工业废水中的重金属离子Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等作沉淀剂,
已知Pb2+与这些离子形成的化合物的溶解度如下:
化合物
| PbSO4
| PbCO3
| PbS
|
溶解度/g
| 1.03×10-4
| 1.81×10-7
| 1.84×10-14
|
由上述数据可知,选用的沉淀剂最好为
A.硫化物? B.硫酸盐? C.碳酸盐? D.以上沉淀剂均可
参考答案:A
本题解析:根据溶度积常数可知,硫化铅的溶度积常数最小,所以最好的沉淀剂是硫化物,答案选A。
点评:对于组成和结构相似的化合物,其溶度积常数越小,沉淀时需要的离子浓度越小。据此可以判断和计算。
本题难度:一般
3、选择题 将氨水滴加到盛有AgCl浊液的试管中,AgCl逐渐溶解,再加入NaBr溶液又产生了浅黄色沉淀。对上述过程,下列理解或解释中正确的是
[? ]
A.Ksp(AgCl)<Ksp(AgBr)
B.若在AgCl浊液中直接加入NaBr溶液,也会产生浅黄色沉淀
C.上述实验说明AgCl没有NaBr稳定
D.因为Ksp(AgCl)>Ksp(AgOH),故氨水能使AgCl溶解
参考答案:B
本题解析:
本题难度:一般
4、选择题 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见下图。下列说法正确的是 ( )
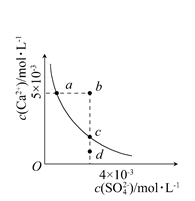
A.在任何溶液中,c(Ca2+)、c(SO42—)均相等
B.b点将有沉淀生成,平衡后溶液中c(SO42—)一定等于3×10-3mol·L-1
C.a点对应的Ksp等于c点对应的Ksp
D.d点溶液通过蒸发可以变到c点
参考答案:C
本题解析:A项只有在CaSO4溶液中c(Ca2+)、c(SO42—)才相等;B项b点Qc>Ksp,故有沉淀生成,开始时,c(Ca2+)、c(SO42—)不相等,而反应消耗的Ca2+、SO42—相等,因此平衡后的两种离子的浓度不会都等于3×10-3mol·L-1,B项错误;在平衡线上的点对应的Ksp均相等,C项正确;D项d点溶液通过蒸发后各离子浓度都增大,不可能保持SO42—浓度不变而到达c点,D项错误。
本题难度:一般
5、选择题 下表是五种银盐的溶度积常数(25 ℃):
化学式
| AgCl
| Ag2SO4
| Ag2S
| AgBr
| AgI
|
溶度积
| 1.8×10-10
| 1.4×10-5
| 6.3×10-50
| 7.7×10-13
| 8.51×10-16
|
?
下列说法不正确的是( )
A.五种物质在常温下Ag2SO4饱和溶液中c(Ag+)最大
B.将氯化银溶解于水后,向其中加入Na2S,则可以生成黑色沉淀
C.对于氯化银、溴化银和碘化银三种物质在常温下的饱和溶液中c(Ag+)随着氯、溴、碘的顺序增大
D.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动
参考答案:C
本题解析:由溶度积的数据可知:AgCl、AgBr、AgI三种物质在常温下的饱和溶液中c(Ag+)随着氯、溴、碘的顺序而减小,C错误,又 =
=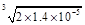 ?mol·L-1>c(Ag+)AgCl=
?mol·L-1>c(Ag+)AgCl= ?mol·L-1,结合前面所述,A正确;由于Ksp(Ag2S)?Ksp(AgCl),将氯化银溶解于水后,向其中加入Na2S,则可以生成黑色沉淀,B正确;溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动,D正确。
?mol·L-1,结合前面所述,A正确;由于Ksp(Ag2S)?Ksp(AgCl),将氯化银溶解于水后,向其中加入Na2S,则可以生成黑色沉淀,B正确;溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动,D正确。
本题难度:一般