微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (15分)某校一研究性学习小组对胆矾晶体受热分解进行讨论。
Ⅰ.他们查阅资料得知:将胆矾晶体置于烘箱中加热时,在79~134℃,晶体失重14.4%;134~250℃,又失重14.4%;250~300℃,再失重7.2%。之后加热至620℃,质量维持不变。小组经过计算得出,胆矾在300~620℃的固体残留物为无水硫酸铜,134℃时的固体残留物的化学式为?。
Ⅱ.小组对无水硫酸铜继续升温加热的可能变化进行猜想。他们提出了产物的以下几种猜想:
①.CuO、SO3;。
②.CuO、SO2和O2;
③.CuO、SO3和SO2;
④.CuO、SO3、SO2和O2
小组经过激烈讨论,认为猜想③不用实验就可排除,他们的理由是?
查阅资料:①SO3为无色晶体,熔点16.6℃,沸点44.8℃。
②SO2,熔点:-72.4℃,沸点:-10℃;SO2通入BaCl2溶液中,无明显现象。
Ⅲ.实验探究:
小组按下图所示安装好实验装置。

(1)安装好装置后,未装药品前必须进行的操作是?。
D装置的作用是?。
(2)按图示装好药品后,用酒精喷灯对着硬质试管加热。一会儿后,B中溶液产生白色浑浊,C中溶液逐渐褪色。
Ⅳ.实验结果分析:
(1)小组同学大多认为无水硫酸铜热分解产物应该为猜想④。但有一个同学提出质疑,他认为B中溶液产生白色浑浊并不一定能确定产物中含有SO3。他的依据涉及的化学方程式是?。于是,小组同学经讨论决定,再增加一个装置E,你认为该装置应加在?(填装置字母)之间。增加装置后,小组重新实验,证明了产物中确实存在SO3。你认为他们根据什么现象得到这一结论??。
(2)小组在完成无水硫酸铜热分解的化学方程式时遇到了困难。他们发现该化学方程式为不定方程式,存在无数种配平情况,经过慎密地分析,他们认为只要能确定某些物质的计量数之比,即可确定该化学方程式。如已知SO2与SO3的计量数之比,就能确定该化学方程式。若设SO2与SO3的计量数之比为x,请写出配平后的化学方程式?。
参考答案:Ⅰ.CuSO4·3H2O
Ⅱ.产物中只有降价元素而无升价元素(从元素守恒角度分析也计分)
Ⅲ.(1)检验装置气密性(1分)?吸收尾气,防止污染环境(合理答案均计分)
Ⅳ.(1)2SO2+O2+2H2O=2H2SO4? H2SO4+BaCl2=BaSO4↓+2HCl(对一个计1分,写总反应方程式计2分)
A B(有错计0分 )? E中试管里出现无色晶体(写液体也给分)
(2) 2(x+1) CuSO4 ?高温 2(x+1)CuO + 2SO3 ↑+ 2xSO2 ↑+ xO2↑
本题解析:Ⅰ.胆矾晶体在79~134℃,晶体失重14.4%,若是1mol晶体,则失去水为250g×14.4%=36g,即2molH2O。134℃时的固体残留物是CuSO4·3H2O。
Ⅱ.③是CuSO4·5H2O变为CuO、SO3和SO2,生成SO2时S的化合价降低,没有元素化合价升高,故假设不成立。
Ⅲ.(1)安装好装置后,未装药品前必须进行的操作是检验装置气密性。D装置中盛放NaOH溶液作用是吸收酸性尾气,防止污染环境。
本题难度:困难
2、选择题 用分液漏斗可以分离的一组混合物是( )
A.碘和乙醇
B.乙醇和水
C.苯和水
D.乙醇和醋酸
参考答案:C
本题解析:
本题难度:一般
3、填空题 (16分)鉴别下列各组物质,按要求回答问题。
(1)稀硫酸、稀盐酸
①可选用鉴别的试剂有(填编号)?▲?(多选题) 。
A.BaCl2溶液?B.Ba(NO3)2溶液? C.Ba(OH)2溶液
②鉴别反应的离子方程式:?▲?。
(2)饱和碳酸钠溶液 、澄清石灰水
、澄清石灰水
①可选用鉴别的试剂有(填编号)?▲?(多选题) 。
a.盐酸?b.硫酸?c.硝酸?d.BaCl2溶液?e.NaCl溶液
②依次写出鉴别中有明显现象的反应的离子方程式:?▲?。
参考答案:

本题解析:略
本题难度:一般
4、选择题 下列操作中,完全正确的一组是( )
①蒸发操作时,当蒸发皿中的水分只残留少许时,停止加热,利用余热将剩余水分蒸干
②蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
③把鼻孔靠近容器口去闻气体的气味
④将试管平放,用药匙或纸槽往试管里送入固体粉末后,再竖立试管
⑤分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
⑥配制一定物质的量浓度溶液的容量瓶必须先干燥
⑦从碘水中萃取碘时,可以在碘水中加入CCl4或酒精作为萃取剂,充分振荡萃取,静置后再分液
⑧使用胶头滴管时应垂直伸进试管内滴加液体
⑨稀释浓硫酸时,把水缓慢倒入盛有浓硫酸的量筒中
⑩检验装置的气密性时,把导管一端浸入水中,用手捂住容器的外壁或用酒精灯微热.
A.①④⑦⑩
B.①②④⑤⑩
C.①④⑤⑦⑧⑩
D.④⑤⑦⑧⑩
参考答案:①蒸发操作时,不能直接蒸干,防止温度过高导致物质分解,可当蒸发皿中的水分只残留少许时,停止加热,利用余热将剩余水分蒸干,故①正确;
②蒸馏操作时,温度的作用是测量馏分的温度,所以应使温度计水银球靠近蒸馏烧瓶的支管口处,故②正确;
③闻气体的气味时,不能把鼻孔靠近容器口直接去闻气体的气味,应用手轻轻煽动,使极少量气体飘进鼻孔,故③错误;
④加入固体药品要防止打碎试管,应用药匙或纸槽往试管里送入固体粉末后,再竖立试管,故④正确;
⑤分液操作时,要防止液体二次污染,应将分液漏斗中下层液体从下口放出,上层液体从上口倒出,故⑤正确;
⑥容量瓶无需干燥,故⑥错误;
⑦酒精易溶于水,不能用作萃取剂,可用苯或四氯化碳,故⑦错误;
⑧胶头滴管不能伸进试管,应悬空垂直,故⑧错误;
⑨不能在量筒中稀释浓硫酸,应将浓硫酸沿烧杯内壁缓缓加入水中,并用玻璃杯不断搅拌,故⑨错误;
⑩可用微热法检验装置的气密性,使装置内压强增大,如有气泡冒出,说明气密性良好,故⑩正确.
故选B.
本题解析:
本题难度:简单
5、实验题 (14分)锰锌软磁铁氧体具有高磁导率、低矫顽力和低功率损耗等性能,已广泛应用于电子工业。碳酸锰主要用于制备锰锌软磁铁氧体,而制碳酸锰的原料之一是二氧化锰。某化学研究性学习小组拟从废旧干电池中回收二氧化锰制取碳酸锰。
①将干电池剖切、分选得到黑色混合物(主要成分为MnO2)洗涤、过滤、烘干。
②将上述固体按固液体积比2:9加入浓盐酸、加热,反应完全后过滤、浓缩。
③向上述溶液中加入Na2CO3溶液,边加边搅拌,再过滤即可得到碳酸锰。
(l)在第②步中,将上述固体与浓盐酸混合的目的是
(2)有人认为,将第③步中的Na2CO3溶液换成NH4HCO3溶液,也能达到上述目的,但同时有气体生成。请写出加入NH4HCO3溶液时发生的离子反应方程式 。
(3)查阅文献,发现第③步中,除生成MnCO3外还有可能生成Mn(OH)2,已知Mn(OH)2暴露在空气中时间稍长,易被氧化成褐色的MnO(OH)2, MnCO3和MnO(OH)2受热最终均分解成MnO2,该小组对上述沉淀的成分提出以下假设,请帮助完成假设:
假设一:全部为MnCO3; 假设二:全部为Mn(OH)2;?假设三:
为验证假设二是否正确,该小组进行了以下研究:
①定性研究:请你完成下表中的内容.
实验步骤(不要求写出具体步骤)
| 预期的实验现象和结论
|
将所得沉淀过滤、洗涤,
|
|
|
|
? ②定量研究:将所得沉淀过滤、洗涤,置于空气中充分氧化后,小心干燥,取22.0g样品,加热,测得固体质量随温度的变化关系如图.根据图中的数据判断假设三成立,理由是 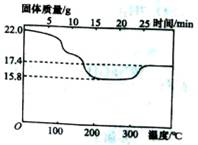
参考答案:(1)将MnO2还原成Mn2+(2)Mn2++2HCO3- = MnCO3↓+ CO2↑+H2O(3)既有MnCO3又有Mn(OH)2
①
实验步骤(不要求写出具体步骤)
预期的实验现象和结论
?
将沉淀充分暴露于空气中,观察颜色
颜色变成褐色,说明含有Mn(OH)2。
?
取少量沉淀于试管中,加入足量的盐酸,观察现象
没有气泡生成,说明不含MnCO3。
②300℃以后,质量增加量为MnO氧化为MnO2 ,计算可得MnCO3质量为11.5(或MnO(OH)2的质量为10.5g),所以既有MnCO3又有Mn(OH)2。
本题解析:(l)在第②步中,将含有MnO2的固体与浓盐酸混合加热发生反应:MnO2+4H+ +2Cl- Mn2++Cl2↑+2H2O可以使MnO2还原转化为Mn2+;(2)根据题意可知:在含有Mn2+离子的溶液中加入NH4HCO3溶液时发生的离子反应是Mn2++2HCO3- = MnCO3↓+ CO2↑+H2O;(2)①将所得沉淀过滤、洗涤将沉淀充分暴露于空气中,观察颜色,颜色变成褐色,说明含有Mn(OH)2;另取少量沉淀于试管中,加入足量的盐酸,观察现象,没有气泡生成,说明不含MnCO3。为此证明固体是Mn(OH)2。②固体质量最小值是15.8g是MnO的质量,在300℃以后,质量增加量为MnO氧化为MnO2。增加的质量是17.4-15.8=1.6g.所以n(MnO)=1.6g÷16g/mol=0.1mol。在15.8g固体中含有MnO质量为0.1mol× 71g/mol =7.1g.含有MnO215.8g-7.1g=8.7g.及含有MnO20.1mol。由于Mn(OH)2暴露在空气中时间稍长,易被氧化成褐色的MnO(OH)2,分解得到MnO2。所以在原固体中含有Mn(OH)20.1mol,质量是0.1mol ×105g/mol =10.5g;则原固体中含有MnCO3质量为22.0g-10. 5g=11.5g。所以原固体中既有MnCO3又有Mn(OH)2。
Mn2++Cl2↑+2H2O可以使MnO2还原转化为Mn2+;(2)根据题意可知:在含有Mn2+离子的溶液中加入NH4HCO3溶液时发生的离子反应是Mn2++2HCO3- = MnCO3↓+ CO2↑+H2O;(2)①将所得沉淀过滤、洗涤将沉淀充分暴露于空气中,观察颜色,颜色变成褐色,说明含有Mn(OH)2;另取少量沉淀于试管中,加入足量的盐酸,观察现象,没有气泡生成,说明不含MnCO3。为此证明固体是Mn(OH)2。②固体质量最小值是15.8g是MnO的质量,在300℃以后,质量增加量为MnO氧化为MnO2。增加的质量是17.4-15.8=1.6g.所以n(MnO)=1.6g÷16g/mol=0.1mol。在15.8g固体中含有MnO质量为0.1mol× 71g/mol =7.1g.含有MnO215.8g-7.1g=8.7g.及含有MnO20.1mol。由于Mn(OH)2暴露在空气中时间稍长,易被氧化成褐色的MnO(OH)2,分解得到MnO2。所以在原固体中含有Mn(OH)20.1mol,质量是0.1mol ×105g/mol =10.5g;则原固体中含有MnCO3质量为22.0g-10. 5g=11.5g。所以原固体中既有MnCO3又有Mn(OH)2。
本题难度:一般