微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关于化学反应的描述中正确的是
A.需要加热才能发生的反应一定是吸热反应
B.反应4Fe(OH)2(s) +02(g)+2H20(l)=4Fe(OH)3(S)的△H>O
C.已知①
②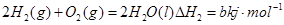 ,则a<b
,则a<b
D.CO(g)的标准燃烧是283.0kJ·mol-1,则2CO2(g)=2CO(g)+O2(g)△H=+566.0kJ·mol-1
参考答案:D
本题解析:反应是放热反应还是吸热反应,与反应条件无关,A不正确;B不正确,该反应是放热反应,△H小于0;由于液态水的能量高于气态水的能量,所以氢气燃烧生成液态水放出的热量多,但放热越多,△H越小,即选项C中a大于b,所以正确的答案选D。
本题难度:一般
2、填空题 已知H+(aq)+OH-(aq)=H2O(l)? ΔH=-57.3 kJ·mol-1。回答有关中和反应的问题。
(1)用0.1 mol Ba(OH)2配成稀溶液与足量稀硝酸反应,能放出________kJ热量。
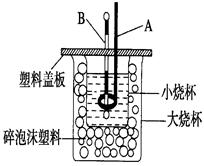
(2)如图装置中仪器A的名称是?,碎泡沫塑料的作用是?。
(3)若通过实验测定中和热的ΔH,其结果常常大于-57.3 kJ·mol-1,其原因可能是?
?。
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会?(填“偏大”、“偏小”、“无影响”)。
参考答案:(1)11.46
(2)环形玻璃搅拌棒;隔热,减少热量散失
(3)实验过程中难免有热量散失(合理答案均可)
(4)偏小
本题解析:(1)由H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ·mol-1可知生成1molH2O放出热量为57.3kJ,而0.1mol Ba(OH)2配成稀溶液与足量稀硝酸反应可得0.2molH2O,所以放出的热量为57.3kJ×0.2=11.46kJ,答案为:11.46;
(2)仪器A的名称是环形玻璃搅拌棒;中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎泡沫塑料的作用是:环形玻璃搅拌棒;隔热,减少热量散失,答案为:环形玻璃搅拌棒;隔热,减少热量散失;
(3)若保温效果不好,有热量散失,求得的中和热数值将会减小,△H大于-57.3kJ·mol-1,答案为:实验过程中难免有热量散失;(合理答案均可)
(4)醋酸为弱酸,电离过程为吸热过程,用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值偏小,故答案为:偏小;
本题难度:简单
3、选择题 下列与化学反应能量变化相关的叙述中正确的是( )
A.在化学反应过程中,发生物质变化的同时不一定发生能量变化
B.放热反应的反应速率总是大于吸热反应的反应速率
C.利用盖斯定律,可计算某些难以直接测量的反应焓变
D.△H的大小与热化学方程式的计量系数无关
参考答案:A.化学反应的本质是旧键断裂,新键生成,在化学反应过程中,发生物质变化的同时一定发生能量变化,故A错误;
B.反应速率与反应是吸热还是放热无关,故B错误;
C.反应的热效应只与始态、终态有关,与过程无关,根据盖斯定律可计算某些难以直接测量的反应焓变,故C正确;
D.△H的大小与热化学方程式的计量系数有关,与参加反应的物质的物质的量无关,故D错误;
故选C.
本题解析:
本题难度:简单
4、选择题 下列反应中,既属于氧化还原反应又属于吸热反应的是(? )
A.锌与硫酸反应制取氢气
B.高温条件下碳粉与二氧化碳的反应
C.高温煅烧石灰石
D.Ba(OH)2·8H2O晶体与NH4Cl固体反应
参考答案:B
本题解析:从化合价有没有改变可排除C、D,而金属与酸置换氢气的反应为放热反应,而答案为B
本题难度:一般
5、选择题 美国普度大学研究开发出一种利用铝镓合金制备氢气的新工艺(工业流程如下所示)。下列有关该工艺的说法错误的是

A.该过程能量转化的形式只有两种
B.铝镓合金可以循环使用
C.铝镓合金与水的反应属于置换反应
D.总反应式为:2H2O = 2H2↑+ O2↑
参考答案:A
本题解析:铝镓合金与水发生反应后,铝把水分解,带走氧气释放出氢气。铝镓合金与水的反应的化学方程式为 ,氧化铝电解又生成铝和氧气,所以总反应式为2H2O = 2H2↑+ O2↑,因此选项BCD都正确。根据过程可判断,反应中会有热量释放出来,所以能量的转化不止2种,A不正确。答案选A。
,氧化铝电解又生成铝和氧气,所以总反应式为2H2O = 2H2↑+ O2↑,因此选项BCD都正确。根据过程可判断,反应中会有热量释放出来,所以能量的转化不止2种,A不正确。答案选A。
本题难度:一般