微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子,其分子结构如图所示,已知断裂1molN—N吸收167kJ热量,生成1molN≡N放出942kJ热量,则下列说法正确的是(? )
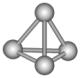
A.N4属于一种新型化合物
B.N4与N2互为同位素
C.N4沸点比P4(白磷)高
D.1molN4气体转变为N2将放出882kJ热量
参考答案:D
本题解析:N4是氮元素的一种单质,和氮气互为同素异形体,AB不正确。N4和白磷都是分子晶体,白磷的相对分子质量大,沸点高,C不正确。因为反应热就是断键吸收大能量和形成化学键所发出的能量的差值,因此1molN4气体转变为N2放出的热量是942kJ×2-167kJ×6=882kJ,D正确,答案选D。
本题难度:简单
2、选择题 下列叙述不正确的是(? )
A.化学平衡发生移动,平衡常数不一定发生变化
B.升高温度会增大化学反应速率,其原因是增大了活化分子的百分数
C.某化学反应的能量变化如图所示,则该反应的ΔH>0,ΔS>0
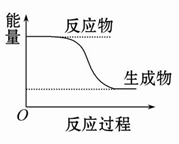
D.H3PO4的电离常数: 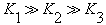
参考答案:C
本题解析:化学平衡发生移动,如果不是改变温度引起的,则平衡常数不变,A对;升高温度,增大了活化分子的百分数,所以反应速率增大,B对;该反应的反应物能量比生成物能量高,反应的ΔH<0,ΔS不能确定,C错;磷酸为弱酸,并且酸性H3PO4>H2PO4->HPO42-,酸性依次减弱,电离程度逐渐减小,D对。
本题难度:一般
3、选择题 下列说法或表示方法中正确的是
A.由C(石墨,s)→C(金刚石,s);ΔH=" +2.1kJ/mol" 可知,石墨比金刚石稳定
B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
C.在101Kpa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);ΔH= +285.8kJ/mol
D.稀溶液中:H+(aq)+OH—(aq)=H2O(l);ΔH=" -57.3kJ/mol" ,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量大于57.3kJ/mol
参考答案:A
本题解析:A项:石墨转化为金刚石吸热,即金刚石的自身能量高,不稳定;
B项:硫固体自身能量低,与硫蒸气相比燃烧时放出的能量应该少。
C项:热化学方程式中的物质系数与焓变的比例错,
D项:浓硫酸与其它溶液混合放热,主要是由它的溶解过程放热所致
本题难度:一般
4、选择题 下列反应中,其中反应物的总能量高于生成物的总能量的是( )
①NaOH溶液中加入盐酸?②由乙醇制C2H4? ③铝热反应?④由氯酸钾制O2
A.①②
B.②③
C.①③
D.①④
参考答案:C
本题解析:根据反应物的总能量高于生成物的总能量的是放热反应分析。①中和反应属于放热反应;②由乙醇制C2H4?属于吸热反应;③铝热反应虽然要点燃镁条,但启动反应后放出大量的热;④由氯酸钾制O2属于吸热反应。故选C。
点评:根据反应物的总能量高于生成物的总能量的是放热反应分析。熟悉反应原理。
本题难度:一般
5、选择题 下列原理所测的中和热最接近-57.3 kJ/mol的是(?)
A.将标况下11.2L HCl气体通入50mL 0.01 mol/L NaOH溶液中反应
B.用55mL 0.01 mol/L Ba(OH)2溶液与50mL 0.01 mol/L HNO3溶液反应
C.用55mL 0.01 mol/L Ba(OH)2溶液与50mL 0.01 mol/L H2SO4溶液反应
D.用55mL 0.01 mol/L NaOH溶液与50mL 0.01 mol/L HF溶液反应
参考答案:B
本题解析:A、稀HCl和稀NaOH反应生成的水的物质的量不一定是1mol,放出的热量不一定为57.3kJ,故A错误;B、生成的水的物质的量是1mol,放出的热量为57.3kJ,故B正确;C、生成的水的物质的量为1mol,且有硫酸钡沉淀生成,放出的热量比57.3kJ多,故C错误.D、氢氟酸是弱酸电离时会吸收热量,放出的热量较少,错误;故选:B。
本题难度:一般