微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)
2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的。因此锂离子电池回收具有重要意义,其中需要重点回收的是正极材料,其主要成分为钴酸锂(LiCoO2)、导电乙炔黑(一种炭黑)、铝箔以及有机粘接剂。某回收工艺流程如下:
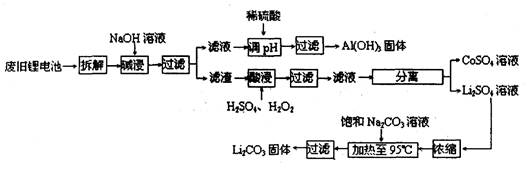
(1)上述工艺回收到的产物有?
(2)Li原子的最外层电子数是?,废旧电池可能由于放电不完全而残留有原子态的锂,为了安全对拆解环境的要求是___________________________________________
(3)碱浸时主要反应的化学方程式为?。
(4)最后一步过滤应趁热过滤,原因是?
参考答案:(1)LiCoO2、Al(OH)3、CoSO4
(2)1,隔绝空气和水
(3)2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑
(4)防止析出硫酸钠晶体。
本题解析:(1)根据流程图可知,回收到的产物有Al(OH)3、CoSO4和Li2CO3。(2)Li是3号元素,最外层一个电子。锂与钠为同一主族,易与水和氧气反应,所以要隔绝空气和水(3)碱浸时,只有铝箔能跟NaOH反应。Na2CO3与LiSO4反应生成Li2CO3沉淀和Na2SO4溶液,Na2SO4溶液冷却会析出固体,所以要趁热过滤。
本题难度:一般
2、实验题 (16分)纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
(1)制备纳米TiO2的方法之一是TiCl4水解生成TiO2·x H2O,该水解反应的化学方程式为 ?。再经过滤、水洗除去其中的Cl–,再烘干、焙烧除去水分得到粉体TiO2。检验TiO2·xH2O中Cl–是否被除净的方法是?。
(2)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
①配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是?;
②滴定终点的现象是?。
③滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol·L-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为?。
④下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果?。
若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果?。
参考答案:(1) TiCl4+(2+x) H2O TiO2·xH2O↓+4HCl(3分)
TiO2·xH2O↓+4HCl(3分)
取少量水洗液,滴加AgNO3溶液,不产生白色沉淀,说明Cl-已除净。(2分)
(2)①抑制 NH4Fe(SO4)2水解(2分)?②溶液变成红色(2分)
③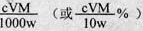 ?(3分)?④偏高(2分)?偏低(2分)
?(3分)?④偏高(2分)?偏低(2分)
本题解析:
⑴水解反应的化学方程式TiCl4+(2+x) H2O TiO2·xH2O↓+4HCl,注意含不定项系数的方程的配平。检验Cl―的方法,取少量水洗液,滴加AgNO3溶液,不产生白色沉淀,说明Cl-已除净。⑵①加入一定量H2SO4的原因:NH4+和Fe2+都能发生水解,溶液呈酸性,加H2SO4提高H2SO4的浓度,抑制 NH4Fe(SO4)2水解。②滴定终点的现象是溶液变成红色
TiO2·xH2O↓+4HCl,注意含不定项系数的方程的配平。检验Cl―的方法,取少量水洗液,滴加AgNO3溶液,不产生白色沉淀,说明Cl-已除净。⑵①加入一定量H2SO4的原因:NH4+和Fe2+都能发生水解,溶液呈酸性,加H2SO4提高H2SO4的浓度,抑制 NH4Fe(SO4)2水解。②滴定终点的现象是溶液变成红色
③ω(TiO2)= ④NH4Fe(SO4)2溶液有少量溅出,使读出的V增大,测定结果偏高;若在滴定终点读取滴定管刻度时,俯视标准液液面,读出的体积变化量偏小,即V值偏小,使测定结果偏低。
④NH4Fe(SO4)2溶液有少量溅出,使读出的V增大,测定结果偏高;若在滴定终点读取滴定管刻度时,俯视标准液液面,读出的体积变化量偏小,即V值偏小,使测定结果偏低。
本题难度:一般
3、填空题 (1)下列反应原理不符合工业冶炼金属实际情况的是( )。
A.2HgO 2Hg+O2↑
2Hg+O2↑
B.Fe3O4+4CO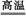 3Fe+4CO2
3Fe+4CO2
C.2MgO 2Mg+O2↑
2Mg+O2↑
D.2Ag2O 4Ag+O2↑
4Ag+O2↑