微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (16分)I.合成氨的原料气H2可通过反应CO(g)+H2O(g)  CO2 (g) +H2(g) 获取。
CO2 (g) +H2(g) 获取。
(1)T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为 ,该温度下反应的平衡常数K值为 。
(2)保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入固定容器中进行反应,下列描述能够说明体系处于平衡状态的是 (填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n (CO) : n (H2O) : n (CO2) : n (H2) = 1 : 16 : 6 : 6
II.(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧实验中相关的反应有:
①4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H1
②4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H2
③4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H3
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1= 。
(2)美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置用铂作为电极、加入碱性电解质溶液,其电池反应为4NH3+3O2=2N2+6H2O
①写出该燃料电池的正极反应式 。
②若用该燃料电池产生的电能在铁皮上镀锌(制白铁皮),某铁皮上现需要镀上9.75g锌,理论上至少需要消耗标准状况的氨气 L。
III.(1)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。由图可知Mg与卤素单质的反应均为 (填“放热”或“吸热”)反应。

(2)金属Mg与CH3Cl在一定条件下反应可生成CH3MgCl,CH3MgCl是一种重要的有机合成试剂,易与水发生水解反应并有无色无味气体和沉淀生成。写出CH3MgCl水解的化学方程式 。
参考答案:(16分)
I.(1) 60 %(2分) 2.25(2分)
(2) c、d(2分)
II.(1)
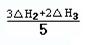 (2分)
(2分)
(2)①O2 + 4e-+ 2H2O  4OH- (2分) ② 2.24 (2分)
4OH- (2分) ② 2.24 (2分)
III.(1)放热 (2分)
(2)2CH3MgCl+H2O=2CH4↑+Mg(OH)2↓+MgCl2或CH3MgCl+H2O=CH4↑+Mg(OH)Cl↓(2分)
本题解析:I.(1)设平衡时CO的浓度减少xmol/L,则
CO(g)+H2O(g)  CO2 (g) +H2(g)
CO2 (g) +H2(g)
开始(mol/L)1/5=0.2 1/5=0.2
转化(mol/L)x x x x
平衡(mol/L)0.2-x 0.2-x x x
根据题意,CO的浓度为0.08 mol·L-1,则0.2-x=0.08,x=0.12,所以CO的转化率是0.12/0.2×100%=60%;
平衡常数K= c(CO2)·c(H2)/c(CO)·c(H2O)=x2/(0.2-x)2=2.25;
(2)a.因为该反应是气体的物质的量不变的可逆反应,则容器内压强始终不随时间改变,不能判断平衡状态,错误;b.因为容器的体积不变,则混合气体的密度始终不随时间改变,不能判断平衡状态,错误; c.单位时间内生成a mol CO2的同时消耗a mol H2,符合正逆反应速率相等,是平衡状态,正确;d.混合气中n (CO) : n (H2O) : n (CO2) : n (H2) = 1 : 16 : 6 : 6时,Qc= c(CO2)·c(H2)/c(CO)·c(H2O)= 6×6/1×16=2.25=K,所以是平衡状态,答案选cd;
II.(1)①中无NO气体,根据盖斯定律,将②×3+③×2 消去NO可得5×①,所以①中的△H1=(3△H2+2△H3)/5;
(2)①根据4NH3+3O2=2N2+6H2O,可知正极是氧气发生还原反应,生成氢氧根离子,所以正极的电极反应式为O2 + 4e-+ 2H2O  4OH-;
4OH-;
②9.75gZn的物质的量是9.75g/65g/mol=0.15mol,则失去电子的物质的量是0.15mol×2=0.30mol,根据得失电子守恒,则氧气得到电子的物质的量是0.30mol,则需要氧气的体积是0.30mol/4×22.4L/mol=1.68L,所以氨气的体积是1.68L×4/3=2.24L.
III.(1)由图可知,反应物的总能量大于生成物的总能量,所以反应为放热反应;
(2)CH3MgCl易与水发生水解反应并有无色无味气体和沉淀生成,该沉淀为氢氧化镁沉淀,根据元素守恒,则该气体中含C元素,为甲烷气体,同时还有氯化镁生成,则反应的化学方程式为2CH3MgCl+H2O=2CH4↑+Mg(OH)2↓+MgCl2。
考点:考查化学平衡的判断、计算,电化学反应原理的应用,化学方程式的判断与书写
本题难度:困难
2、填空题 (9分)写出298 K时,下列反应的热化学方程式:
(1)1mol HgO(s)分解为液态汞和氧气,吸热90.7 kJ。____________________________________
(2)在稀溶液中1 mol H2SO4与足量NaOH反应放热114.6 kJ,表示该中和热的热化学方程式为
(3)在101 kPa时,H2在1 mol O2中完全燃烧生成2 mol液态水,放出571.6 kJ的热量,H2的燃烧热为 ,表示H2燃烧热的热化学方程式为_
(4)火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。已知N2 (g) + 2O2 (g) =2NO2 (g) △H ="+67.7" kJ/mol
N2H4 (g) +O2 (g) =N2 (g) + 2H2O (g) △H =" -534" kJ/mol
则N2H4 (g)和二氧化氮反应的热化学方程式为
参考答案:(1)HgO(s)="Hg(l)+" 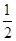 O2(g) △H ="+90.7" kJ/mol(2分)
O2(g) △H ="+90.7" kJ/mol(2分)
(2)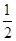 H2SO4(aq)+NaOH(aq)===
H2SO4(aq)+NaOH(aq)===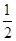 Na2SO4(aq)+H2O(l) △H =" -57.3" kJ/mol(2分)
Na2SO4(aq)+H2O(l) △H =" -57.3" kJ/mol(2分)
(3) 285.8kJ/mol (1分)
H2(g)+ 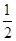 O2(g)===H2O(l);ΔH=-285.8kJ·mol-1(2分)
O2(g)===H2O(l);ΔH=-285.8kJ·mol-1(2分)
(4) 2N2H4 (g) +2 NO2 (g)="3" N2 (g) + 4H2O (g) ΔH=-1135.7 kJ·mol-1(2分)
本题解析:(1)根据热化学方程式的书写原则,物质要注明状态,反应热与物质的物质的量有对应关系,物质的系数为物质的量,故写成HgO(s)="Hg(l)+" 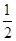 O2(g) △H ="+90.7" kJ/mol ;(2)根据中和热的定义,稀的强酸强碱反应生成1摩尔水时放出的热量为中和热,根据热化学方程式的书写原则写成
O2(g) △H ="+90.7" kJ/mol ;(2)根据中和热的定义,稀的强酸强碱反应生成1摩尔水时放出的热量为中和热,根据热化学方程式的书写原则写成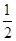 H2SO4(aq)+NaOH(aq)===
H2SO4(aq)+NaOH(aq)===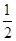 Na2SO4(aq)+H2O(l) △H =" -57.3" kJ/mol ;(3)氢气的燃烧热是指1摩尔氢气反应生成液态水时放出的热量,根据题意,是2摩尔氢气反应放热571.6 kJ ,所以1摩尔氢气放热285.8kJ ,氢气的燃烧热为285.8kJ/mol ,燃烧热的热化学方程式写成H2(g)+ 1/2 O2(g)===H2O(l);ΔH=-285.8kJ/mol ;(4)将所给的热化学方程式标为①和②,运用盖斯定律,②×2-①得出N2H4 (g)和二氧化氮反应的热化学方程式为2N2H4 (g) +2 NO2 (g)="3" N2 (g) + 4H2O (g) ΔH=-1135.7 kJ·mol-1。
Na2SO4(aq)+H2O(l) △H =" -57.3" kJ/mol ;(3)氢气的燃烧热是指1摩尔氢气反应生成液态水时放出的热量,根据题意,是2摩尔氢气反应放热571.6 kJ ,所以1摩尔氢气放热285.8kJ ,氢气的燃烧热为285.8kJ/mol ,燃烧热的热化学方程式写成H2(g)+ 1/2 O2(g)===H2O(l);ΔH=-285.8kJ/mol ;(4)将所给的热化学方程式标为①和②,运用盖斯定律,②×2-①得出N2H4 (g)和二氧化氮反应的热化学方程式为2N2H4 (g) +2 NO2 (g)="3" N2 (g) + 4H2O (g) ΔH=-1135.7 kJ·mol-1。
考点:中和热,燃烧热,热化学方程式的书写和含义,盖斯定律。
本题难度:一般
3、简答题 Ⅰ.氮是地球小含量最丰富6一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:

(1)41是1mol&tb得p;tO2和1mol&tb得p;CO反应生成CO2和tO过程中能量变化示意4,请写出tO2和&tb得p;CO反应6热化学方程式______
t/℃
200
300
400
K
K1
K2
0.5
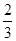 ;把方程1乘以
;把方程1乘以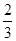 ;然后三者相加;即-△H3×2+△H2×
;然后三者相加;即-△H3×2+△H2×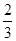 +△H1×
+△H1×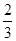 =
=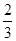 (△H1+△H2-3△H3).
(△H1+△H2-3△H3).