微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ/mol
②CH3OH(g)+
O2(g)=CO2(g)+2H2(g)△H=-192.9kJ/mol
根据上述反应,下列说法正确的是( )
A.反应①中的能量变化如图所示

B.CH3OH转变成H2的过程一定要吸收能量
C.1?mol?CH3OH充分燃烧放出的热量为192.9?kJ
D.可推知2H2(g)+O2(g)=2H2O(g)△H=-483.8?kJ/mol
参考答案:D
本题解析:
本题难度:简单
2、简答题 氨气是一种重要的物质,可用于制取化肥和硝酸等.
(1)工业合成氨的热化学方程式:N2(g)+3H2(g)?2NH3(g);△H=-92.2KJ/mol.有关键能:
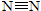
:946.5KJ/mol;N-H:391.0KJ/mol;则H-H键能为______.
(2)合成氨原料中的H2可用甲烷在高温下与水蒸气反应制得.部分1mol物质完全燃烧生成常温下稳定氧化物的△H数据如下表:已知1molH2O(g)转变为1molH2O(l)时放热44.0KJ.写出CH4和水蒸气在高温下反应得到CO和H2的热化学方程式______.
| 物质 | △H(KJ/mol)
H2(g)
-285.8
CO(g)
-283.0
CH4(g)
-890.3
|
(3)若把标准状况下6.72L氨气通入到100g19.6%的硫酸溶液中,所得溶液中的溶质是______,溶液中离子浓度从大到小的顺序是______.
参考答案:(1)因反应热等于反应物的总键能减去生成物的总键能,设H-H键能为 xKJ/mol,则
?945.6kJ/mol+3xKJ/mol-6×391.0kJ/mol=-92.2kJ/mol? 解得x=436.1,
?故答案为:436.1kJ/mol;
(2)CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol? ①
? H2(g)+12O2(g)═H2O(l)△H=-285.8KJ/mol? ②
? CO(g)+12O2(g)═CO2(g)△H=-283KJ/mol? ③
? ?而H2O(g)═H2O(l)△H=44.0kJ/mol?④
根据盖斯定律:④+①-②×3-③,得
CH4(g)+H2O(g)═CO(g)+3H2(g)的△H=44KJ/mol-890.3KJ/mol+285.8KJ/mol×3+283KJ/mol=+206.1kJ/mol,
故答案为:CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.1kJ/mol;
(3)6.72L即0.3mol氨气通入到100g19.6%即0.2mol的硫酸溶液中:NH3+H2SO4=NH4HSO4,生成0.2molNH4HSO4,NH3过量0.1mol,与NH4HSO4反应:NH3+NH4HSO4=(NH4)2SO4,生成0.1mol(NH4)2SO4,过量0.1molNH4HSO4,所以溶质为NH4HSO4、(NH4)2SO4,NH4HSO4能电离出等量的铵根、氢离子和硫酸根,(NH4)2SO4电离出铵根、硫酸根,虽然铵根离子水解,但浓度最大,故答案为:NH4HSO4、(NH4)2SO4;c(NH+)>c(SO42-)>c(H+)>c(OH-).
本题解析:
本题难度:一般
3、选择题 相同温度下,有下列三个热化学方程式
(1)H2(g)+1/2O2(g)=== H2O(g) △H1= -Q1kJ·mol-1
(2)2H2(g)+O2(g)=== 2H2O(l) △H1= -Q2kJ·mol-1
(3)2H2(g)+O2(g)=== 2H2O(g) △H1= -Q3kJ·mol-1
则Q1、Q2、Q3的关系表示正确的是
[? ]
A.Q1=Q2<Q3
B.Q2>Q3>Q1
C.Q3>Q2>Q1
D.Q1=Q2=Q3
参考答案:B
本题解析:
本题难度:一般
4、选择题 根据以下3个热化学方程式,下列有关Q1、Q2、Q3三者关系的判断中正确的是
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H=―Q1 kJ/mol
2H2S(g)+O2(g)=2S(s)+2H2O(l) △H=―Q2 kJ/mol
2H2S(g)+O2(g)=2S(s)+2H2O(g) △H=―Q3 kJ/mol
[? ]
A.Q1>Q2>Q3
B.Q1>Q3>Q2
C.Q3>Q2>Q1
D.Q2>Q1>Q3
参考答案:A
本题解析:
本题难度:一般
5、填空题 (1)由磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的热化学方程式为:4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g) ΔH
①上述反应中,副产物矿渣可用来________。
②已知相同条件下:
4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) ΔH1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g) ΔH2
SiO2(s)+CaO(s)=CaSiO3(s) ΔH3
用ΔH1、ΔH2和ΔH3表示ΔH,ΔH=____________。
(2)(江苏)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
①Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)ΔH1=+64.39 kJ·mol-1
②2H2O2(l)=2H2O(l)+O2(g)ΔH2=-196.46 kJ·mol-1
③H2(g)+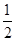 O2(g)=H2O(l)ΔH3=-285.84 kJ·mol-1
O2(g)=H2O(l)ΔH3=-285.84 kJ·mol-1
在H2SO4溶液中,Cu与H2O2反应生成Cu2+和H2O的热化学方程式为_________________________________________________________________。
参考答案:(1)①制玻璃 ②ΔH1+3ΔH2+18ΔH3
(2)Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l) ΔH=-319.68 kJ·mol-1
本题解析:(1)①CaSiO3为玻璃的成分之一,从而确定矿渣用途。②根据盖斯定律知ΔH=ΔH1+3ΔH2+18ΔH3。
(2)由热化学方程式①+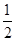 ×②+③得:
×②+③得:
Cu(s)+2H+(aq)+H2O2(l)=Cu2+(aq)+2H2O(l)
ΔH=ΔH1+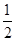 ×ΔH2+ΔH3=+64.39 kJ·mol-1+
×ΔH2+ΔH3=+64.39 kJ·mol-1+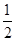 ×(-196.46 kJ·mol-1)+(-285.84 kJ·mol-1)=-319.68 kJ·mol-1。
×(-196.46 kJ·mol-1)+(-285.84 kJ·mol-1)=-319.68 kJ·mol-1。
本题难度:一般