微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 国际上不提倡伊朗浓缩铀,因为铀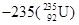 是制造原子弹的燃料。
是制造原子弹的燃料。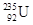 原子核内含有中子数为
原子核内含有中子数为
A.92
B.235
C.143
D.327
参考答案:C
本题解析:铀 质子数是92,质量数是235,由于质量数等于质子数与中子数的和,所以中子数是235-92=143。因此选项是C。
质子数是92,质量数是235,由于质量数等于质子数与中子数的和,所以中子数是235-92=143。因此选项是C。
本题难度:简单
2、选择题 下列关于卤族元素的说法中,不正确的是(?)
A.单质的熔点和沸点随核电荷数的增加逐渐升高
B.单质的颜色随核电荷数的增加逐渐加深
C.单质的氧化性随核电荷数的增加逐渐增强
D.氢化物的稳定性随核电荷数的增加逐渐减弱
参考答案:C
本题解析:略
本题难度:简单
3、选择题 下列各项比较中正确的是
A.共价键极性CCl4>SiCl4
B.沸点CH3CH2OH>CH3CH2Cl
C.元素的电负性Ca>Mg
D.晶格能KCl>NaCl
参考答案:B
本题解析:A:所涉及的Cl、C、Si元素的非金属性Cl > C > Si,所以SiCl4的极性大
B:前者为液太,后者为气态,正确;C:二者相比,前者金属性强,电负性小;
D:二者相比,Na+的半径小于K+半径,NaCl晶格能更大。
本题难度:一般
4、选择题 某元素的电离能(单位:电子伏特)如下表,此元素位于元素周期表的族数是(?)
I1
| I2
| I3
| I4
| I5
| I6
| I7
|
14.5
| 29.6
| 47.4
| 77.5
| 97.9
| 551.9
| 666.8
|
A. ⅢA? B.ⅣA?C.ⅥA?D.ⅤA?
参考答案:D
本题解析:根据电离能的大小可判断,第6电离能比第5电离能大很多,这说明该元素的最高价是+5价,所以属于第ⅤA,答案选D。
本题难度:一般
5、填空题 (共11分)西瓜膨大剂别名氯吡苯脲,是经过国家批准的植物生长调节剂,实践证明长期使用对人体无害。已知其相关理化性质如下表所示:
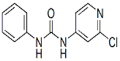
分子式
| 结构简式
| 外观
| 熔点
| 溶解性
|
C12H10ClN3O
|
| 白色结晶粉末
| 170~172°C
| 易溶于水
|
(1)氯元素基态原子核外电子的未成对电子数为?。
(2)氯吡苯脲的晶体类型为_______?,所含第二周期元素第一电离能从大到小的顺序为__________________。
(3)氯吡苯脲晶体中,氮原子的杂化轨道类型为______?_。
(4)查文献可知,可用2-氯-4-氨基吡啶与异氰酸苯酯反应,生成氯吡苯脲。
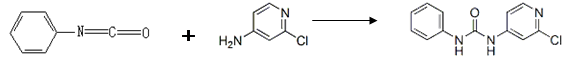
反应过程中,每生成1mol氯吡苯脲,断裂_______个σ键、断裂_______个π键
(5)波尔多液为常见杀菌剂,喷洒后生成可溶的硫酸铜溶液,加入氨水,形成蓝色沉淀,继续加入氨水,难溶物溶解变成深蓝色透明溶液,得到配位数为4的的配合物。写出沉淀溶解的离子方程式?。
参考答案:(1)1?(2)分子晶体? N> O> C?(3)sp2? SP3?(2分)
(4)NA(或6.02×1023)? NA(或6.02×1023)?(每空2分)?
(5)Cu(OH)2+ 4NH3·H2O = [Cu (NH3)4]2+ + 2OH-+ 4H2O (2分)
本题解析:(1)根据构造原理可知元素氯的基态原子电子排布式1s22s22p63s23p5,所以氯元素基态原子核外电子的未成对电子数为1。
(2)氯吡苯脲比较低,易溶于水中,所以是分子晶体。同周期自左向右电离能逐渐最大,但氮原子的最外层是半充满,稳定性强,即氮的第一电离能最大所以是N> O> C。
(3)根据结构简式可知和羰基相连的氮原子形成的化学键全部是单键,属于sp3杂化。在圆环上的氮原子形成双键和单键,属于sp2杂化。
(4)根据反应前后的结构简式的变化分析,异氰酸苯酯中碳氮双键断裂,2-氯-4-氨基吡啶中氮氢键断裂,所以各是1mol。
(5)配位数为4,说明铜离子结合4个氨气,所以方程式为Cu(OH)2+ 4NH3·H2O = [Cu (NH3)4]2+ + 2OH-+ 4H2O。
本题难度:一般