微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列排序正确的是(? )
A.酸性:H2CO3<C6H5OH<H3COOH
B.碱性:Ba(OH)2<Ca(OH)2<KOH
C.熔点:MgBr2<SiCl4<BN
D.沸点:PH3<NH3<H2O
参考答案:D
本题解析:A项中酸性正确的顺序为:C6H5OH<H2CO3<CH3COOH,故A项错;B项碱性正确的顺序为:Ca(OH)2<Ba(OH)2,故B型错;SiCl4为分子晶体,MgBr2为离子晶体,离子晶体的熔点高于分子晶体,所以SiCl4的熔点小于MgBr2,C项错误;H2O、NH3分子间存在氢键,沸点高,而H2O的沸点为100℃,NH3在常温时为气体,所以H2O的沸点高于NH3,故D项正确。
【考点定位】本题考查酸性、碱性、熔点、沸点的变化规律。
本题难度:简单
2、填空题 (11分)A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子分别位于IA ,? IIIA , VIA族且同周期,B对应碱呈两性,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:
A ??,B?,C?,D?,E?
(2)写A与E两元素可形成化合物的电子式:??。
(3)写出A、B两元素的最高价氧化物的水化物之间的相互反应的化学方程式:
??。
(4) 比较C、D的最高价氧化物的水化物的酸性的强弱:??。(用化学式表示)
参考答案:(11分)
(1)A:Na,? B:Al,? C:Si,? D:P,? E:S?(每空1分,共5分)
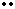 (2)
(2)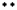

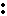
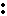



 Na? +? S? +? Na? Na S Na
Na? +? S? +? Na? Na S Na
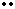
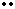 (2分)
(2分)
(3)Al(OH)3+ NaOH ="==" NaAlO2+2H2O?(2分)
(4)H3PO4>H2SiO3?(2分)
本题解析:(1).首先题目给出是短周期元素,因此定位在前三周期中,B原子位于IIIA族且对应碱呈两性,由此推出B是A(第三周期IIIA族)l;A、B、E在同一周期,且A是IA族,E是VIA,由此推出A是Na,E是S。A、B、E最高价氧化物的水化物分别是NaOH、Al(OH)3和H2SO4;C元素的原子序数比B大且最外层电子数比次外层电子数少4,则推出C是Si,D就是P。
(2)Na原子最外电子层上只有1个电子,S原子最外电子层上有6个电子,形成的化合物是Na2S。
(3)A、B最高价氧化物的水化物分别是NaOH、Al(OH)3他们间的反应式为Al(OH)3+ NaOH ="==" NaAlO2+2H2O
(4)Si、P是同一周期的元素,非金属性逐渐减弱,对应的最高价氧化物的水化物的酸性也逐渐减弱。所以H3PO4>H2SiO3
本题难度:一般
3、选择题 主族元素单质及化合物在许多性质上都存在着递变规律。下列有关说法不正确的是?)

A.卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深
B.氧族元素氢化物稳定性按H2O、H2S、H2Se、H2Te的顺序依次减小
C.氢化物的沸点按NH3、BiH3、SbH3、AsH3、PH3的顺序依次递减
D.最高价氧化物对应水化物碱性按NaOH、KOH、RbOH、CsOH的顺序依次增强
参考答案:C
本题解析:A正确,卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深;B正确,氧族元素氢化物稳定性按H2O、H2S、H2Se、H2Te的顺序依次减小;C错,NH3分子间存在氢键,沸点最高;D正确,最高价氧化物对应水化物碱性按NaOH、KOH、RbOH、CsOH的顺序依次增强;
本题难度:一般
4、选择题 已知短周期元素的离子aA2+、bB+、cC3-、dD- 都具有相同的电子层结构,则下列叙述正确的是
A.原子半径A>B>D>C
B.原子序数 d > c > b > a
C.离子半径C>D>B>A
D.单质的还原性A>B>D>C
参考答案:C
本题解析:根据“阴上阳下”的判断规律,C、D在上一周期,C得电子数大于D,所以d>c;A、B在下一周期,A失电子数大于B所以a>b。A、电子层数越多,半径越大,核电荷数越少,半径越大,所以原子半径B最大,错误;B、原子序数a>b>d>c,错误;C、4种离子的电子层数相同,所以决定离子半径的是核电荷数,与原子序数的大小关系顺序相反,正确;D、元素周期表中B在A的左侧,所以B的还原性大于A,错误,答案选C。
本题难度:一般
5、选择题 由于镁燃烧发出耀眼的白光,因此常用来制造信号弹和焰火。下列元素与镁元素处于同一主族的是
A.Be
B.He
C.O
D.P
参考答案:A
本题解析:镁是第二主族的元素,第二主族的元素从上到下依次为铍、镁、钙、锶、钡、镭,所以选A。
本题难度:简单