微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知A、B、C、D、E、F、G位于元素周期表的前四周期,且元素原子序数依次增加,A焰色反应呈黄色;工业常用电解B的熔融的氯化物来制备B,C是一种能被HF和NaOH溶液溶解的单质,D的电负性比磷大,第一电离能却比磷小,E单质是制备漂白液的原料,F能形成红色(或砖红色)和黑色的两种氧化物,G是一种主族金属。
(1)前四周期所有元素中,基态原子中未成对电子与其所在周期数相同的元素有?种。
(2)元素A、B、C分别与氟气化合形成物质X、Y、Z熔点见下表:
解释表中氟化物熔点差异的原因:?。
(3)已知常温条件下,极性分子DOE2是一种液态化合物,中心原子D的杂化方式是?。向盛有10mL水的锥形瓶中滴加少量的DOE2溶液,生成两种有刺激性气味的气体。请书写此反应的化学方程式?。
(4)G与氮原子可1:1化合,形成人工合成的新型半导体材料,其晶体结构与单晶硅相似。G原子的价电子排布式为?。在该合成材料中,与同一个G原子相连的N原子构成的空间构型为正四面体。在四种基本晶体类型中,此晶体属于?晶体。
(5)F晶体的堆积方式是?(填堆积名称),其配位数为?。 向F的硫酸盐溶液中滴加氨水直至过量,写出此过程所涉及的两个离子方程式?根据价层电子对互斥理论,预测SO42-的空间构型为?。
参考答案:(1)5(1分)
(2)NaF和MgF2为离子晶体,SiF4为分子晶体,(1分) MgF2的晶格能大于NaF(1分) (3)SP3(1分)? SOCl2 + H2O = SO2↑+ 2HCl↑(2分)
(4)4s2p1(1分),原子(1分)
(5)面心立方最密堆积(1分),? 12(1分), Cu2+ + 2NH3·H2O = Cu(OH)2↓+ 2NH4+(2分)Cu(OH)2 + 4NH3·H2O = [Cu(NH3)4]2+ + 4H2O + 2OH-(或将NH3·H2O写成NH3)(2分),?正四面体(1分)
本题解析:A、B、C、D、E、F、G位于元素周期表的前四周期,且元素原子序数依次增加,A焰色反应呈黄色是Na;工业常用电解B的熔融的氯化物来制备B,是Mg;C是一种能被HF和NaOH溶液溶解的单质,是Si;D的电负性比磷大,第一电离能却比磷小,是S;E单质是制备漂白液的原料,为Cl;F能形成红色(或砖红色)和黑色的两种氧化物,为Cu;G是一种主族金属。
(1)前四周期所有元素中,基态原子中未成对电子与其所在周期数相同的元素有1s1,2s22p2或2s22p4,3s23p3,3d64s2(注意根据洪特规则3d44s2是3d54s1),共5种。
(2)元素Na、Mg、Si分别与氟气化合形成物质X(NaF)、Y(MgF2)、Z(SiF4)熔点NaF和MgF2为离子晶体,SiF4为分子晶体,MgF2的晶格能大于NaF。
(3)已知常温条件下,极性分子SOCl2是一种液态化合物,中心原子S有价层电子4对,杂化方式是SP3。向盛有10mL水的锥形瓶中滴加少量的SOCl2溶液,生成两种有刺激性气味的气体为水解,即SO2和HCl。
(4)G与氮原子可1:1化合,形成人工合成的新型半导体材料,其晶体结构与单晶硅相似。物质分子式是GN,G为+3价,在Cu之后,故是G原子的价电子排布式为4s2p1。在该合成材料中,与同一个G原子相连的N原子构成的空间构型为正四面体。在四种基本晶体类型中,此晶体属于原子晶体。
(5)Cu晶体的堆积方式是面心立方最密堆积,其配位数为12。 向CuSO4溶液中滴加氨水直至过量,Cu2+先生成Cu(OH)2沉淀,在溶解为[Cu(NH3)4]2+,根据价层电子对互斥理论,SO42-的价层电子为4对,空间构型为正四面体。
本题难度:一般
2、填空题 我国的探月工程正在有计划的进行着,最近发射的嫦娥二号卫星又圆满完成了多项科学任务。月球上的主要矿物有辉石[CaMgSi2O6]、斜长石[KAlSi3O8]和橄榄石(可分为铁橄榄石[Fe2SiO4]、镁橄榄石[Mg2SiO4]、铁-镁橄榄石[(Mg?Fe)2SiO4])等。
(1)铁橄榄石中铁元素化合价为______,硅元素原子核外电子排布式为_____________。
(2)硅元素的原子核外共有______种不同能级的电子,其原子最外层共有_____种不同运动状态的电子。
(3)月球上的上述主要矿物中,属于短周期元素的原子半径由大到小依次为__________
(填相应的元素符号),在这些短周期元素中,其单质晶体微粒间存在两种相互作用的是_____元素。
(4)某元素与氧元素同周期,且与氧元素组成的化合物中氧元素显正+2价,写出一个化学方程式 ,说明该元素与氧元素的非金属性的强弱______________________
,说明该元素与氧元素的非金属性的强弱______________________ __。
__。
参考答案:(1)(2分)+2? 1s2 2s22p63s23p2。
(2)(2分)5,4。
(3)(2分)Mg>Al>Si>O,氧
(4)(2分)2F2+2H2O→4HF+O2。
本题解析:略
本题难度:一般
3、选择题 下列说法错误的是(?)。
A.原子半径:F<Mg<K
B.稳定性:PH3>H2S>NH3
C.酸性:H3PO4<H2SO4<HClO4
D.碱性:Al(OH)3<Mg(OH)2<KOH
参考答案:B
本题解析:非金属性越强,相应氢化物的稳定性越强,B中非金属性是N>S>P,所以选项B不正确,其余都是正确的,答案选B。
本题难度:一般
4、选择题 甲、乙、丙、丁为四种主族元素,已知甲与乙、丙、丁三种元素相邻,甲、乙的原子序数之和等于丙的原子序数,四种元素原子的最外层电子数之和为20。下列判断中正确的
是(?)
A.原子半径:丙>乙>甲
B.最外层电子数:丙=丁
C.气态氢化物的稳定性:甲>丙
D.最高价氧化物对应的水化物的酸性:丁>甲
参考答案:C
本题解析:由于甲、乙的原子序数之和等于丙的原子序数,且甲与乙、丙、丁相邻,故甲、乙、丁处于同一周期,丙在下一周期,则有如下两种位置关系:①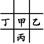 或②
或②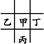 。若是①可设甲的原子序数为x,则乙为x+1,丁为x-1,丙为x+8,则有:x+x+1=x+8,x=7,即甲为N,乙为O,丁为C,丙为P,则四种元素原子的最外层电子数之和为20,符合题意。同理验证②不合题意。原子半径丙(P)>甲(N)>乙(O),A项错误;丙(P)最外层电子数为5,而丁(C)最外层电子数为4,B项错误;甲元素的氢化物为NH3,丙元素对应的氢化物为PH3,显然稳定性前者强,C项正确;最高价氧化物对应的水化物的酸性:HNO3>H2CO3,D项错误。
。若是①可设甲的原子序数为x,则乙为x+1,丁为x-1,丙为x+8,则有:x+x+1=x+8,x=7,即甲为N,乙为O,丁为C,丙为P,则四种元素原子的最外层电子数之和为20,符合题意。同理验证②不合题意。原子半径丙(P)>甲(N)>乙(O),A项错误;丙(P)最外层电子数为5,而丁(C)最外层电子数为4,B项错误;甲元素的氢化物为NH3,丙元素对应的氢化物为PH3,显然稳定性前者强,C项正确;最高价氧化物对应的水化物的酸性:HNO3>H2CO3,D项错误。
本题难度:一般
5、选择题 不符合原子核外电子排布基本规律的是?
A.核外电子总是优先排在能量最低的电子层上
B.K层是能量最低的电子层
C.N电子层为次外层时,最多可容纳的电子数为18
D.各电子层(n)最多可容纳的电子数为n2
参考答案:D
本题解析:A.核外电子总是首先排布在离核近、能量低的电子层上,故A正确;
B.K层离原子核最近,能量最低,故B正确;
C.N层最多可以排布2×42个电子,为最外层是最多排8个,为次外层时最多排18个,故C正确;
D.各电子层(n)最多可容纳的电子数为2n2故D错误;
故选A。
点评:本题考查了原子核外电子排布的规律,题目难度不大,考查学生对基础知识的掌握程度。
本题难度:一般