微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用惰性电极电解M(NO3)x的水溶液,当阴极上增重a g时,在阳极上同时产生b L氧气(标准状况),则M的相对原子质量为(?)
A.
B.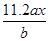
C.
D.
参考答案:C
本题解析:在电解池反应中,电极材料为惰性材料的,在阴极是阳离子放电,在阳极是阴离子放电,由于阴极增重说明M为不活泼的金属,Mx+阳离子在阴极放电,阳极是OH-在放电;当有b L氧气(标准状况)产生时,失电子数为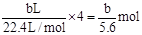 ,所以Mx+得电子数为
,所以Mx+得电子数为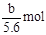 ,则Mx+的物质的量为
,则Mx+的物质的量为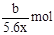 ,所以M的相对原子质量为
,所以M的相对原子质量为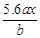 。答案选C。
。答案选C。
点评:本题主要根据得失电子数相等来进行计算。
本题难度:一般
2、填空题 (10分)某同学用碳棒、纯铜片、直流电源和稀硫酸为原材料,实现了在通常条件下不能发生的反应:Cu + H2SO4(稀) = CuSO4 + H2↑
(1)请在右边方框中画出能够实现这一反应的装置图。

(2)在设计实验实际操作时,由于装置连接不当,他看到了完全不同的实验现象:碳棒和铜片上均有无色气泡产生,溶液并未变为蓝色。请你分析其原因?①?。
假设按照该方案进行实验,且收集到碳棒上产生气体体积为11. 2L(标准状况下)。则该过程中铜片上发生的反应式为?②?。此时要使溶液恢复到实验前的状态,需加入?③?(写出该物质的化学式),其质量为? ④?。
参考答案:(1)  ?
?
(2)①两极与电源的正负极接反了?②2H++2e-= H2↑?③H2O?④18g
本题解析:(1)根据方程式可知,Cu做阳极,石墨做阴极,H2SO4做电解质溶液,所以装置图为
(2)如果电极放反,则阳极为:4OH- -4e-=O2↑+2H2O,阴极为2H++2e-=H2↑,所以看不到预期的现象。要想恢复到实验前的状态需要加入水,因为生成O2 11.2L,则需要水18g。
点评:电解中最关键的是准确判断出电极上离子的放电顺序。在判断电解产物时,首先判断阳极电极材料。如果是活性电极,则电极本身失去电子。如果是惰性电极,则溶液中的阴离子失去电子。而阴极是溶液中的阳离子得到电子,所以需要熟练记住常见离子的放电顺序。
本题难度:一般
3、填空题 由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与NaOH溶液反应制得纯净的白色的Fe(OH)2沉淀,若用下图实验装置,则可制得。两极材料分别为石墨和铁。

⑴a电极材料为?,电极反应为?。
⑵电解液d可以是?,则白色沉淀在电极上产生;也可以是?,,则白色沉淀在两极之间的溶液中产生。
A.纯水? B.NaCl溶液
C.NaOH溶液? D.CuCl2溶液
⑶液体c为苯,作用是?,
在加苯之前对d溶液进行加热处理的目的是?
?。
⑷为了短时间内看到白色沉淀可采取的措施是(?)
A.该用稀硫酸作电解质溶液? B.适当增大电源电压
C.适当缩小两极的距离? D.适当降低电解液温度
参考答案:⑴铁,Fe→Fe2++2e-;⑵C ,B ;⑶隔绝空气,防止Fe(OH)2被空气氧化;排尽溶液中的O2,防止生成的Fe(OH)2在溶液中被氧化;⑷BC。
本题解析:要产生Fe(OH)2白色沉淀,必须通过电解产生Fe2+,只有Fe作阳极才有可能,另外Fe(OH)2极易被氧化,要与空气隔绝。那么,OH-来自哪里?一是溶液本身存在,如NaOH溶液,二是有水电离出的H+放电留下的OH-得到,如NaCl溶液。
本题难度:一般
4、填空题 请按要求回答下列问题。
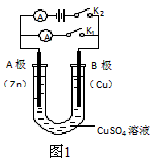
(1)根据图1回答①②
①打开K2,合并K1。 A电极可观察到的现象是__________;B极的电极反应为 __________。
②打开K1,合并K2。 A电极可观察到的现象是_________ ;B极的电极反应为 ___________;
(2)根据图2回答③④
③将较纯净的CuSO4溶液放入下图所示的装置中进行电解,石墨电极上的电极反应式为_____________, 电解反应的离子方程式为_____________;
④实验完成后,铜电极增重a g,石墨电极产生标准状况下的气体体积___________L。
 ?
? 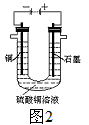
参考答案:(1)①锌不断溶解;Cu2++2e-==Cu ;
②A镀上一层红色的铜;Cu-2e-==Cu2+
(2)③4OH--4e-==2H2O+O2; 2Cu2++2H2O 2Cu+2O2+4H+;
2Cu+2O2+4H+;
④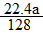 L
L
本题解析:
本题难度:一般
5、选择题 如下图两个电解槽中,A、B、C、D均为石墨电极。若电解过程中共有0.02mol电子通过,下列叙述中正确的是

[? ]
A.甲烧杯中A极上最多可析出铜0.64g
B.甲烧杯中B极上电极反应式4OH--4e-=2H2O+O2↑
C.乙烧杯中滴入酚酞试液,D极附近先变红
D.烧杯中C极上电极反应式为4H++4e-=2H2↑
参考答案:C
本题解析:
本题难度:一般