微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)工业上,以钛铁矿为原料制备二氧化钛的工艺流程如下图所示。钛铁矿主要成分为钛酸亚铁(FeTiO3),其中一部分铁元素在风化过程中会转化为+3价。
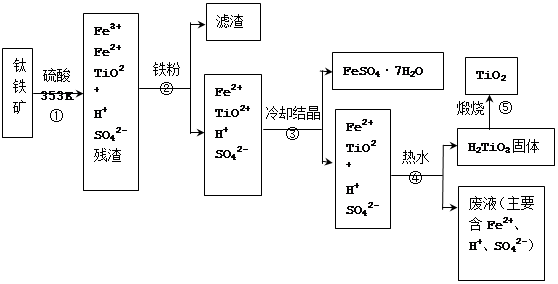
已知:TiOSO4遇水会水解。
(1)步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为?。
(2)步骤③中,实现混合物的分离是利用物质的?(填字母序号)。a. 熔沸点差异 b. 溶解性差异? c. 氧化性、还原性差异
(3)步骤②、③、④中,均需用到操作是?(填操作名称)。
(4)可以利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水),则反应的离子方程式为?。
(5)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用下图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。
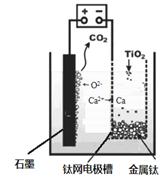
①写出阳极所发生反应的电极反应式:?。
②在制备金属钛前后,CaO的总量不变,其原因是
(请结合化学用语解释)?
参考答案:(1)2Fe3+ + Fe =3Fe2+?(2分)(2)b? (1分)(3)过滤(1分)
(4)MnO2 + 2Fe2+ + 4H+ = Mn2+ + 2Fe3+ + 2H2O(2分)
(5)① 2O2- - 4e- = O2↑或 C + 2O2- - 4e- = CO2↑(2分)
②制备TiO2时,在电解槽发生如下反应:2CaO 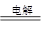 2Ca + O2↑,? 2Ca + TiO2 ="Ti" + 2CaO,由此可见,CaO的量不变。或:?制备TiO2时,在电解槽发生如下反应:
2Ca + O2↑,? 2Ca + TiO2 ="Ti" + 2CaO,由此可见,CaO的量不变。或:?制备TiO2时,在电解槽发生如下反应:
阴极:2Ca2+ + 4e- = 2Ca?
阳极:2O2- - 4e- = O2↑
2Ca + TiO2 =" Ti" + 2CaO,由此可见,CaO的量不变。(2分)
本题解析:(1)铁离子能把铁单质氧化生成亚铁离子,方程式为2Fe3+ + Fe =3Fe2+?。
(2)冷却结晶,有固体析出,因此是利用了物质溶解性的差异,答案选b。
(3)根据流程图可知,三次实验中均产生不溶性物质,所以都需要过滤。
(4)二氧化锰具有氧化性,能氧化废液中的亚铁离子,方程式为MnO2 + 2Fe2+ + 4H+ = Mn2+ + 2Fe3+ + 2H2O。
(5)①电解池中阳极失去电子,所以根据熔融体中的离子可知,应该是氧离子失去电子,即 2O2- - 4e- = O2↑或 C + 2O2- - 4e- = CO2↑。
②由于制备TiO2时,在电解槽发生如下反应:2CaO 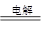 2Ca + O2↑,? 2Ca + TiO2 ="Ti" + 2CaO,所以CaO的量不变。
2Ca + O2↑,? 2Ca + TiO2 ="Ti" + 2CaO,所以CaO的量不变。
本题难度:一般
2、选择题 铸造硬币所用合金的实际价值比其面值
A.高
B.低
C.相等
D.高或相等
参考答案:C ?
本题解析:硬币的实际价值与其面值等价。
本题难度:一般
3、填空题 (11分)海水中化学资源的利用具有非常广阔的前景。
(1)目前世界上60%的镁是从海水中提取的,其主要步骤如下:

①试剂Ⅰ适宜选用?(填序号)。
A.盐酸? B.石灰乳? C.氯化钠溶液?
②操作Ⅰ的名称是?。
③工业上通过电解熔融的MgCl2制备金属Mg,该反应的化学方程式是?。
(2)下图是某课外小组在实验室模拟从海水中提取溴的实验装置。
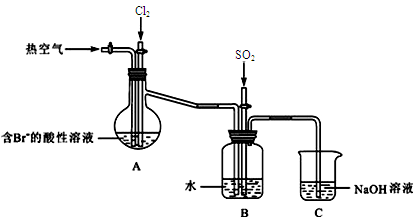
A装置中通入Cl2一段时间后,改通热空气,将Br2吹出至B装置。
①A装置中发生反应生成Br2的离子方程式为?。
② B装置中,Br2被SO2还原,B装置中产生的两种主要阴离子的符号为?、?。
③C装置中NaOH溶液的作用是?。
参考答案:(1)①B?②过滤?③ MgCl2 ?Mg + Cl2↑
?Mg + Cl2↑
(2)①Cl2+2Brˉ=== 2Clˉ+Br2?② SO ? Brˉ
? Brˉ
③防止Cl2、SO2、Br2对环境污染(答出一点即可)
本题解析:⑴①据题意选项中只有石灰乳与MgSO4反应生成Mg(OH)2沉淀。
②通过过滤将Mg(OH)2沉淀分离出来。
③电解熔融的MgCl2生成Mg和Cl2。
⑵①A装置中Cl2与Brˉ发生氧化还原反应生成Br2和Clˉ。
②Br2与SO2在水溶液中反应方程式为Br2+ SO2+2H2O=H2SO4+2HBr,其产生的两种阴离子为SO 和Brˉ。
和Brˉ。
③该装置会带来Cl2、SO2、Br2等有毒气体,用NaOH溶液能吸收这些气体,防止其污染空气。
本题难度:一般
4、选择题 美国的哥伦比亚号航天飞机在制造过程中应用了大量的先进复合材料,其中被覆在整个机身上的防热瓦片,使航天飞机能安全穿越大气层,是耐高温的( )
A.陶瓷基复合材料
B.合成树脂基复合材料
C.玻璃钢
D.金属基复合材料
参考答案:A
本题解析:
本题难度:简单
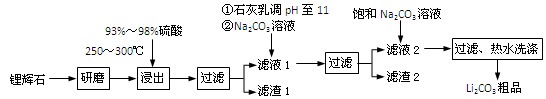
5、填空题 (共12分) 工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:
已知:① Li2O·Al2O3·4SiO2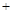 H2SO4(浓)
H2SO4(浓) Li2SO4
Li2SO4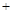 Al2O3·4SiO2·H2O↓
Al2O3·4SiO2·H2O↓
② 某些物质的溶解度(S)如下表所示:
T/℃
| 20
| 40
| 60
| 80
|
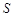 (Li2CO3)/g (Li2CO3)/g
| 1.33
| 1.17
| 1.01
| 0.85
|
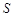 (Li2SO4)/g (Li2SO4)/g
| 34.2
| 32.8
| 31.9
| 30.7
|
③ 从滤渣1中分离出Al2O3的部分流程如下图所示:
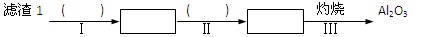
(1)、请依次写出在括号内加入试剂的化学式 、 。
(2)、请依次写出方框中所得到物质的化学式 、 。
(3)、步骤Ⅰ中反应的离子方程式是 。
(4)、已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述) 。
(5)、向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是
。
(6)、氧化铝在工业上用作高温耐火材料,制耐火砖、坩埚、瓷器、人造宝石等,同时氧化铝也是炼铝的原料。写出用氧化铝炼铝的化学方程式: 。
参考答案:(1). HCl(其它合理答案也给分)?(1分) ?NH3·H2O? (1分)?
(2). AlCl3 (其它合理答案也给分) ?(1分)? Al(OH)3?(1分)
(3).Al2O3+6H+→Al3++3H2O ?(2分)
(4).增加Ca2+、OH-的浓度,有利于Mg(OH)2、CaCO3的析出(其它合理答案也给分) ?(2分)
(5).Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失(2分)
(6).2Al2O3(熔融) 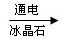 4Al+3O2↑? (2分)
4Al+3O2↑? (2分)
本题解析:(1).滤渣中含有氧化铝和二氧化硅,氧化铝是两性氧化物,所以先加入盐酸,将氧化铝溶解过滤及得到氯化铝溶液,然后通入氨气即可得到氢氧化铝沉淀,氢氧化铝灼烧即得到氧化铝。
(2)略
(3)氧化铝和盐酸反应的离子方程式为Al2O3+6H+→Al3++3H2O。
(4)加入石灰乳,可以增加Ca2+、OH-的浓度,有利于平衡向生成Mg(OH)2、CaCO3的方向进行。
(5)根据溶解度可知,Li2CO3的溶解度随温度升高而减小,所以热水洗涤可减少Li2CO3的损失。
(6)氧化铝电解生成越强和单质铝,方程式为2Al2O3(熔融) 4Al+3O2↑ 。
4Al+3O2↑ 。
本题难度:一般