微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、推断题 H、C、N、O、都属于自然界中常见非金属元素。
(1)O、C、N三种元素的第一电离能由小到大顺序是?;NH4+中氮原子轨道的杂化类型为________。
 (2)CO、N2的结构可表示为:?
(2)CO、N2的结构可表示为:?
两者的键能数据:(单位kJ/mol)
?
| A—B
| A=B
| 
|
CO
| 357.7
| 798.9
| 1071.9
|
N2
| 154.8
| 418.4
| 941.7
|
?
结合数据说明CO比N2活泼的原因?。
(3)乙二胺(H2N-CH2-CH2-NH2)和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是?。
(4)C、N元素形成的新材料具有如图所示结构,该晶体硬度将超过目前世界上最硬的金刚石,成为首屈一指的超硬新材料。?该物质的化学式为:?。

参考答案:(8分)
(1)C O N?(1分) ;sp3杂化(1分)
(2)CO的第一个π键的键能为273kJ/mol,N2中的第一个π键的键能为523.3kJ/mol,所以CO的第一个键比N2更容易断裂。(2分)
(3)乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键,在气化时要破坏氢键,所以需要更多能量,沸点前者较高。
(4)C3N4(2分)
本题解析:
(1)由于N原子最外层是半充满结构,能量比较低,难以失电子,所以第一电离能比相邻原子的大,故顺序为C O N?;根据价层电子对互斥理论可以NH4+中氮sp3杂化;
(2)根据表中的数据可知:CO的第一个π键的键能为273kJ/mol,N2中的第一个π键的键能为523.3kJ/mol,所以CO的第一个键比N2更容易断裂。
(3)乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键。
(4)晶胞中微粒数计算为:碳,8*11/8+4*1/2=3,氮:4个,故化学式为C3N4。
本题难度:一般
2、选择题 下列变化过程中无化学键断裂或生成的是?
[? ]
A.石墨转化为金刚石
B.NaCl晶体溶于水
C.干冰升华
D.氮的固定
参考答案:C
本题解析:
本题难度:简单
3、选择题 关于氢键,下列说法正确的是(?)
A.乙酸的沸点比甲酸甲酯高
B.邻羟基苯甲酸的沸点比对羟基苯甲酸的沸点高
C.HF是一种非常稳定的化合物,这是由于氢键所致
D.冰中存在范德华力和氢键,而液态水中只存在范德华力
参考答案:A
本题解析:氢键不是化学键,不能影响分子的稳定性,一般影响的是物质的物理性质。邻羟基苯甲酸中存在分子内氢键,对羟基苯甲酸存在分之间氢键,所以前者的沸点比后者的沸点低,选项B不正确;HF稳定不是氢键导致的,选项C不正确;水中也存在氢键,选项D不正确,因此正确的答案选A。
本题难度:一般
4、选择题 膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含有磷化氢。它的分子构型是三角锥形。以下关于PH3的叙述正确的是
[? ]
A.PH3分子中有未成键的孤对电子
B.PH3是非极性分子
C.PH3是一种强氧化剂
D.PH3分子的P-H键是非极性键
参考答案:A
本题解析:
本题难度:一般
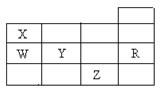
5、选择题 右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
A.常压下五种元素的单质中,Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的沸点比X的氢化物的沸点高
D.Y元素的非金属性比W元素的非金属性强