微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列变化中需加入氧化剂才能实现的是
A.Cl-→Cl2
B.Fe3+→Fe2+
C.CuO→Cu
D.H2SO4→BaSO4
参考答案:A
本题解析:需加入氧化剂才能实现,说明该微粒是还原剂,元素的化合价是升高的,所以A正确。BC中化合价都降低的,需要加入还原剂,D中化合价不变,不是氧化还原反应,答案选A。
本题难度:简单
2、选择题 将0.1 molCu与40 mL 10 mol/L HNO3充分反应,测得反应后的溶液里含有a mol H+,由此可知
[? ]
A.生成的气体一定是NO2在标准状况下的体积4.48 L
B.生成的气体一定是NO,在标准状况下的体积约1.49 L
C.被还原的硝酸的物质的量为(0.2 -a)mol
D.反应后的溶液里含有0.2 molNO3-
参考答案:C
本题解析:
本题难度:一般
3、实验题 (1)?利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。
Ni(s)+4CO(g)?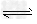 Ni(CO)4(g)?该反应的ΔH_________0?(选填“>”或“=”或“<”)。
Ni(CO)4(g)?该反应的ΔH_________0?(选填“>”或“=”或“<”)。
(2)?在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g)?ΔH1=-393.5?kJ·mol-1
CO2(g)+C(s)=2CO(g)?ΔH2=+?172.5?kJ·mol-1
S(s)+O2(g)=SO2(g)?ΔH3=-296.?0?kJ·mol-1
请写出CO除SO2的热?化学方程式__________。
(3)?已知Na2CrO4溶液酸化时发生的反应为:2CrO42-+2H+? Cr2O72-+H2O,若1L酸化后所得溶液中铬元素的总?物质的量为0.55?mol,CrO42-有10/11转化为Cr2O72-。又知:常温时该反应的平衡常数K=1014。求上述酸化后所得溶?液的pH_________。
Cr2O72-+H2O,若1L酸化后所得溶液中铬元素的总?物质的量为0.55?mol,CrO42-有10/11转化为Cr2O72-。又知:常温时该反应的平衡常数K=1014。求上述酸化后所得溶?液的pH_________。
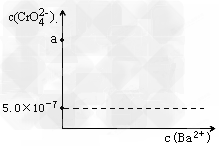
(4)?根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7?mol·L-1以下才能排放。含CrO42-的废水处理通常有以下两种方法。
①?沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于_________mol·L-1,然后再进行后续?处理方能达到国家排放?标准。若原废水中CrO42-浓度为a?mol/L,请在图中画出c(CrO42-)与c(Ba2+)的关系图,并进行必要的标注。
②?还原法:CrO42-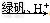 Cr3+
Cr3+ Cr(OH)3。用该方法处理10?m3?CrO42-的物质的量浓度为1.0×10-3?mol·L-1的废水,至少需要绿矾(FeSO4·7H2O,相对分子质量为278)__________Kg(保留两位小数)。
Cr(OH)3。用该方法处理10?m3?CrO42-的物质的量浓度为1.0×10-3?mol·L-1的废水,至少需要绿矾(FeSO4·7H2O,相对分子质量为278)__________Kg(保留两位小数)。
参考答案:(1)<
(2)2CO(g)+SO2(g)=S(s)+2CO2(g)?ΔH=-270?kJ·mol-1
(3)?6?;
(4)2.4×10-4?;?8.34
本题解析:
本题难度:一般
4、选择题 我校化学兴趣小组做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色。则该条件下
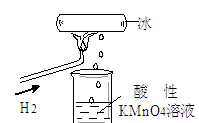
A.生成的水分子化学性质比较活泼
B.H2燃烧生成了具有氧化性的物质
C.H2燃烧的产物中可能含有一定量的H2O2
D.H2被冷却为液态氢,液氢的水溶液具有还原性
参考答案:C
本题解析:从反应现象可看出,生成了一种物质:既具有氧化性又具有还原性:2MnO + 5H2O2+ 6H+= 2Mn2++ 5O2↑+8H2O和H2O2+2H+ +2Fe2+=2Fe3++2H2O,答案为C
+ 5H2O2+ 6H+= 2Mn2++ 5O2↑+8H2O和H2O2+2H+ +2Fe2+=2Fe3++2H2O,答案为C
本题难度:简单
5、选择题 用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.2mol Cu(OH)2后恰好恢复到电解前的浓度。则电解过程中转移的电子为
[? ]
A.0.4 mol
B.0.6 mol
C.0.2 mol
D.0.8 mol
参考答案:D
本题解析:
本题难度:一般