微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 A、B、C、D四种短周期元素,原子序数依次增大,A、C同主族,C、D同周期,B原子最外层电子数是最内层电子数的3倍.A、B可形成A2B和A2B2两种液态化合物,B、C也可形成C2B和C2B2两种固态化合物.C+具有与氖原子相同核外电子排布.D原子最外层电子数比B原子最外层电子数多一个电子,根据以上条件,判断:
(1)四种元素符号分别是:
A______?B______?C______?D______
(2)①A2B和C2B2反应化学方程式______②A2B2中加入少量MnO2反应方程式______.
参考答案:(1)由短周期元素,原子序数依次增大,B原子最外层电子数是最内层电子数的3倍,则B为2个电子层,质子数为8符合题意,即B为O元素;A、B可形成A2B和A2B2两种液态化合物,化合物为水和过氧化氢,则A为H元素;B、C也可形成C2B和C2B2两种固态化合物,化合物为氧化钠、过氧化钠,C+具有与氖原子相同核外电子排布,则C为Na元素;A、C同主族,C、D同周期,D原子最外层电子数比B原子最外层电子数多一个电子,则D有三个电子层,最外层电子数为7,即D为Cl元素,
故答案为:H;O;Na;Cl;?
(2)①A2B和C2B2反应为2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2H2O=4NaOH+O2↑;
②A2B2中加入少量MnO2反应为2H2O2?MnO2?.?2H2O+O2↑,故答案为:2H2O2?MnO2?.?2H2O+O2↑.
本题解析:
本题难度:一般
2、选择题 下列叙述正确的是( )
A.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
B.原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键
C.强电解质一定为离子化合物,共价化合物一定为弱电解质
D.完全由非金属元素组成的化合物可以形成离子化合物
参考答案:D
本题解析:
本题难度:简单
3、选择题 化学科学需要借助化学专用语言来描述,下列化学用语的书写正确的是( )
A.
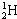
B.
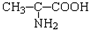
C.

D.OHCCHO
参考答案:A、H原子的质子数为1,在左下角,质量数为2,在左上角,核素的正确写法为12H,故A错误;
B、结构中少了一个H原子,正确的写法为
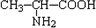
,故B错误;
C、过氧化氢为共价化合物,正确的写法为
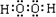
,故C错误;
D、-CHO为醛基,则OHCCHO为乙二醛的化学结构简式,满足乙二醛的结构特点,故D正确;
故选D.
本题解析:
本题难度:一般
4、简答题 已知X、Y、Z都是短周期元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的三倍,Y和Z可以形成两种以上的气态化合物,则
(1)写出下列元素名称:X是______,Z是______.
(2)由Y和Z组成,且Y和Z的质量比为7:20的化合物的分子式是______.
(3)写出由X、Y、Z中的两种元素组成,且与X2Z分子具有相同电子数的两种阴、阳离子______和______,其中阴离子的电子式为______.
(4)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子个数比为4:2:3,该盐的化学式是______;如果向该盐溶液中加入铜和稀硫酸,溶液变蓝色,试写出离子方程式______;如果将该盐固体与熟石灰混合加热,会产生一种刺激性气味的气体,试写出化学方程式______.
参考答案:(1)因为电子层数为2、3的短周期元素的核外电子数最少分别为3个、11个,而X原子的电子层数与它的核外电子总数相同,则电子层数、核外电子数均为1,X是H元素;Z的最外层电子数是次外层的3倍,即次外层电子数2个、最外层电子数6个,Z是O元素;2-7号元素中,只有N能和O形成N2O、NO、N2O3、NO2等多种气态化合物,故Y是N元素,
故答案为:氢、氧;
(2)m(Y):m(Z)=7:20,可知n(Y):n(Z)=714:2016=2:5,对应化合物为N2O5,故答案为:N2O5;
(3)X2Z即H2O有10个电子,与之含有相同电子数的离子有NH4+、OH-、H3O+等,其中阴离子为OH-,电子式为
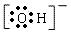
,阳离子为NH4+或H3O+,
故答案为:OH-;NH4+或H3O+;
(4)该盐的化学式为NH4NO3,其中H、N、O的个数比为4:2:3,如果向该盐溶液中加入铜和稀硫酸,在酸性条件下NO3-具有强氧化性,与铜发生氧化还原反应而使铜溶解,
反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,如果将该盐固体与熟石灰混合加热,会产生一种刺激性气味的气体NH3,
反应的化学方程式为2NH4NO3+Ca(OH)2?△?.?2NH3↑+Ca(NO3)2+2H2O,
故答案为:NH4NO3;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;2NH4NO3+Ca(OH)2?△?.?2NH3↑+Ca(NO3)2+2H2O.
本题解析:
本题难度:一般
5、填空题 (18分)U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)V的单质分子的结构式为_______________;XW的电子式为____________;
Y元素在周期表中的位置是___________? __。
(2)U元素形成的同素异形体的晶体类型可能是(填序号)?。
①原子晶体?②离子晶体?③分子晶体?④金属晶体
(3)U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)____________;V、W的氢化物分子结合H+能力较强的是(写化学式)______________;U的氢化物的标准燃烧热为-890.31kJ·mol-1,请写出其燃烧的热化学方程式:??
(4)YW2气体通人BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为__________________________________________,由此可知VW和YW2还原性较强的是(写化学式)______________________________。
参考答案:
 (1)N≡N;
(1)N≡N; ;第三周期ⅥA族。(2) ①③?
;第三周期ⅥA族。(2) ①③?
(3)CH4; NH3, CH4(g) +2O2(g)=CO2(g)+2H2O(l)?△H=-890.31KJ·mol-1。
(4)3SO2+3Ba2+ +2H2O +2NO3- =3BaSO4↓+2NO↑ + 4H+, SO2。
本题解析:Y的单质在W2中燃烧的产物可使品红溶液褪色,所以Y是S,W是O元素;Z和W元素形成的化合物Z3W4具有磁性,因此Z是Fe。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体,因此U是碳,X是镁。营业务U、V、W、X、Y、Z是原子序数依次增大的六种常见元素,所以V是氮元素。
(1)氮气中含有氮氮三键,所以气结构式是N≡N;XW是氧化镁,氧化镁是含有离子键的离子化合物,电子式为 。S元素的原子序数是16,位于第三周期ⅥA族。由于氨水是弱碱,所以氨气极易结合氢离子生成NH4+。
。S元素的原子序数是16,位于第三周期ⅥA族。由于氨水是弱碱,所以氨气极易结合氢离子生成NH4+。
(2)在碳元素形成的单质中金刚石是原子晶体,而C60是分子晶体,不存在离子晶体和金属晶体,答案选①③。
(3)U、V、W形成的10电子氢化物是甲烷、氨气和水。由于水分子间存在氢键,所以水的沸点最高,较低是甲烷和氨气。燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以热化学方程式是CH4(g) +2O2(g)=CO2(g)+2H2O(l)? △H=-890.31KJ·mol-1。
(4)由于硝酸具有氧化性,能把SO2氧化生成硫酸,而还原产物是NO,反应的离子方程式是3SO2+3Ba2+ +2H2O +2NO3- =3BaSO4↓+2NO↑ + 4H+。在氧化还原反应中还原剂的还原性强于还原产物的,所以还原性较强的是SO2。
本题难度:一般