微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定温度下,用水稀释0.1mol?L-1的一元弱酸HA,随稀释进行,下列数值一定增大的是(Kw表示水的离子积,Ka表示HA的电离常数)( )
A.Kw
B.
C.
D.c(OH-)
参考答案:A.温度不变,水的离子积常数不变,故A错误;
B.加水稀释促进弱酸电离,氢离子的物质的量增大,但溶液体积增大的倍数大于氢离子增大的物质的量,溶液氢原子浓度减小,温度不变,电离平衡常数不变,所以c(H+)Ka减小,故B错误;
C.加水稀释促进弱酸电离,所以酸分子个数减小,酸根离子个数增大,则c(HA)c(A-),故C错误;
D.加水稀释,溶液中氢离子浓度减小,温度不变,水的离子积常数不变,则氢氧根离子浓度增大,故D正确;
故选D.
本题解析:
本题难度:一般
2、填空题 有pH=1的①盐酸②硫酸③醋酸
(1)设三种溶液的物质的量浓度分别为a、b、c,则其大小关系为?。
(2)同体积的三种溶液与足量的NaOH溶液反应生成盐的物质的量分别为a、b、c,则其大小关系为?。
(3)完全中和物质的量浓度和体积都相同的NaOH溶液时,需三种酸溶液的体积分别为a、b、c,则其大小关系为?。
参考答案:(1)c>a>b? (2)? c >a >b? (3) a=b>c
本题解析:因为硫酸是二元强酸,盐酸是一元强酸,醋酸是一元弱酸,所以在pH相等的条件下,物质的量浓度是c>a>b。
(2)由于酸的浓度大小顺序是c>a>b,所以生成的盐的大小顺序是c>a>b。
(3)在pH相等的条件下,强酸消耗的氢氧化钠相同,弱酸最多,即a=b>c
本题难度:一般
3、简答题 室温下,下列关于pH均为9、体积均为10ml的NaOH溶液和CH3COONa溶液比较的说法,正确的是( )
A.两种溶液中的c(Na+)相等
B.分别加热到相同温度时,CH3COONa溶液的pH小
C.分别加水稀释到100mL时,两种溶液的pH依然相等
D.两溶液中由水电离出的c(OH-)之比为
参考答案:A.两溶液因pH均为9,因此c(?CH3COONa)大于c(NaOH),因此CH3COONa溶液中c(Na+)大于NaOH溶液中c(Na+),故A错误;
B.分别加热到相同温度时,NaOH溶液pH变化不大,加热促进CH3COONa水解,其pH增大,故B错误;
C.分别加水稀释到100mL时促进CH3COONa水解,pH减小的小,故C错误;
D.NaOH溶液中由水电离出的c(OH-)为10-9mol/L,CH3COONa溶液中由水电离出的c(OH-)为10-5mol/L,之比为10-910-5,故D正确;
故选D.
本题解析:
本题难度:一般
4、选择题 氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是
A.1mol/L氢氰酸溶液的pH约为3
B.HCN易溶于水
C.10mL 1mol/L HCN恰好与10mL 1mol/L NaOH溶液完全反应
D.HCN溶液的导电性比HCl溶液的弱
参考答案:A
本题解析:证明电解质是弱电解质的方法可从以下三个角度考虑:(1)看其电离程度,(2)看是否存在电离平衡,(3)测其盐溶液的pH;A、氢氰酸为一元酸pH约为3,电离生成的氢离子约为10-3mol/L<1mol/L,电离不完全,正确;B、不能利用物质的溶解性来判断是否为弱电解质,即溶解性与电解质的强弱无关,错误;C、10mL1mol/LHCN恰好与10mL1mol/LNaOH溶液完全反应,只能说明HCN为一元酸,不能说明其电离的程度,错误;D、溶液的导电性取决于溶液中的离子浓度大小,与酸性强弱无关,HCN溶液的导电性比强酸溶液的弱,不能说明HCN电离不完全,错误。
本题难度:一般
5、选择题 用蒸馏水稀释0.1 mol/L醋酸时,始终保持增大趋势的是? ( )
A.溶液中的c(CH3COO-)
B.溶液中的c(H+)
C.醋酸的电离平衡常数
D.溶液中的c(OH-)
参考答案:D
本题解析:醋酸溶液存在如下电离平衡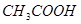 ?
? ;加水稀释,平衡向右移动,所以
;加水稀释,平衡向右移动,所以
A错,加水稀释,溶液中的c(CH3COO-)呈减小趋势;B错,加水稀释,溶液中的c(H+)呈减小趋势;C错,电离平衡常数只受温度影响,与其他因素无关;D正确,溶液中的c(H+)呈减小趋势则溶液中的c(OH-)呈增大趋势;
本题难度:一般