微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 (1)将反应2FeCl3+Fe=3FeCl2设计成原电池。____________________
(2)判断正负极并写出电极反应。________________________
参考答案:(1)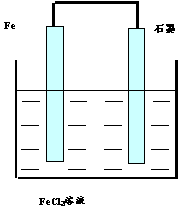
(2)负极(铁):Fe-2e-=Fe2+;正极(石墨):Fe3++e-=Fe2+
本题解析:
本题难度:一般
2、选择题 一种新型乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍。电池总反应为:C2H5OH +3O2= 2CO2 +3H2O,电池示意图如下图。下面对这种电池的说法正确的是

A.b极为电池的负极
B.电池工作时电子由a极沿导线经灯泡再到b极
C.电池正极的电极反应为:4H+ +O2+4e-=2H2O
D.标准状况下,通入5.6LO2并完全反应后,有0.5mol电子转移
参考答案:BC
本题解析:略
本题难度:一般
3、选择题 某原电池总反应为2Fe3++Fe=3Fe2+,不能实现该反应的原电池是
[? ]
A.正极为Cu,负极为Fe,电解质溶液为FeCl3
B.正极为C,负极为Fe,电解质溶液为Fe(NO3)3
C.正极为C,负极为Fe,电解质溶液为Fe2(SO4)3
D.正极为Ag,负极为Fe,电解质溶液为CuSO4
参考答案:D
本题解析:
本题难度:一般
4、填空题 银锌碱性蓄电池是一种可以反复充电、放电的装置.电池放电时的反应原理是:Zn+Ag2O+H2O=2Ag+Zn(OH)2.

现用该蓄电池电解c(NO3-)=6mol?L-1的KNO3和Cu(NO3)2的混合溶液500mL,当通电一段时间后,两极均收集到22.4L气体(标准状况)(电解池的电极均为石墨电极).
回答下列问题:
(1)银锌碱性蓄电池的正极反应式为______.
(2)电解过程中,阳极反应式为______;阴极反应式为______.
(3)上述电解过程中共转移电子总数______.
(4)电解得到的Cu的质量为______.
(5)原混合溶液中c(K+)为______.
(6)电解后溶液中c(H+)______4mol/L(选填“<”“=”“>”).
参考答案:(1)该原电池中,较活泼的金属锌失电子作负极,氧化银作正极,正极上氧化银得电子和水反应生成银和氢氧根离子,电极反应式为:Ag2O+H2O+2e-=2Ag+2OH-.
故答案为:Ag2O+H2O+2e-=2Ag+2OH-.
(2)电解过程中,阳极上氢氧根放电生成氧气和水,4OH--4e-=2H2O+O2↑;阴极上先是铜离子放电生成铜,当铜离子完全析出时,氢离子放电生成氢气,电极反应式为Cu2++2e-=Cu,2H++2e-=H2(或4H2O+4e-=2H2+4OH-).
故答案为:4OH--4e-=2H2O+O2↑;Cu2++2e-=Cu,2H++2e-=H2(或4H2O+4e-=2H2+4OH-).
(3)电解过程中,阳极上失电子,阴极上得电子,根据氧气与转移电子之间的关系式计算.
设转移电子为X.
4OH--4e-=2H2O+O2↑;
? 4NA? 22.4L
? X?22.4L?
X=4NA
故答案为4NA.
(4)氢氧根离子失去4NA 电子析出22.4L氧气转移电子,氢离子得到2NA电子析出22.4L氢气,所以铜离子得到2NA
电子析出铜单质.
设铜单质的质量是y.
Cu2++2e-=Cu?
?2NA? 64g
? 2NA y
?y=64g.
故答案为64g.
(5)铜的质量是64g,其物质的量是1mol,则C(Cu2+)=1mol0.5L=2mol/L,c(NO3-)=6mol?L-1;设钾离子的物质的量浓度为z,根据溶液呈电中性,溶液中阴阳离子所带电量相等得,2C(Cu2+)+C(K+)=c(NO3-),所以
C(K+)=c(NO3-)-2C(Cu2+)=2mol/L.
故答案为:2?mol?L-1 .
(6)根据4OH--4e-=2H2O+O2↑知,生成22.4L氧气需要氢氧根离子4mol,根据2H++2e-=H2↑知,生成22.4L氢气需要氢离子2mol,水电离出的氢离子和氢氧根离子个数相同,所以溶液中氢离子的物质的量是2mol,电解过程中溶液的体积减小,所以c(H+)>2mol0.5L=4mol/L.
故答案为>.
本题解析:
本题难度:简单
5、填空题 人工固氮是指将氮元素由游离态转化为化合态的过程。
I.最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实验氮的固定一电解法合成氨,大大提高了氮气和氢气的转化率。总反应式为:N2(g)+3H2(g) 2NH3(g),则在电解法合成氨的过程中,应将H2不断地通入_________极(填“阴”或“阳”) ;向另一电极通入N2,该电极的反应式为__________________________。
2NH3(g),则在电解法合成氨的过程中,应将H2不断地通入_________极(填“阴”或“阳”) ;向另一电极通入N2,该电极的反应式为__________________________。
II.据报道,在一定条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,主要产物为NH3,相应的反应方程式为:2N2(g)+6H2O(g) 4NH3(g)+3O2(g)?△H=Q。
4NH3(g)+3O2(g)?△H=Q。
(1)上述反应的平衡常数表达式为_______________。
(2)取五份等体积N2和H2O的混合气体(物质的量之比均为1:3),分别加入体积相同的恒容密闭容器中,在温度不相同的情况下发生反应,反应相同时间后,测得氮气的体积分数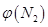 与反应温度T的关系曲线如图所示,则上述反应的Q________0(填“>”、“<”或“=”)。
与反应温度T的关系曲线如图所示,则上述反应的Q________0(填“>”、“<”或“=”)。
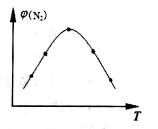
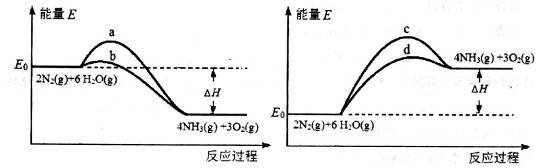
(3)若上述反应在有催化剂的情况下发生,则下图所示的a、b、c、d四条曲线中,能表示反应体系能量变化的是_______(选填字母代号),图中△H的绝对值为1530kJ·mol-1。
III.目前工业合成氨的原理是:N2(g)+3H2(g) 2NH3(g)?△H=-93.0kJ/mol。
2NH3(g)?△H=-93.0kJ/mol。
回答下列问题:
(1)结合II中的数据,则O2(g)+2H2(g)=2H2O(g)的△H=______________。
(2)在一定温度下,将1molN2和3mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8mol。
①达平衡时,H2的转化率α1=______________。
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率为α2,当α1+α2=1时,则起始时NH3的物质的量n(NH3)=_____________mol。
参考答案:Ⅰ.?阳(1分)? N2+6H++6e-===2NH3 (2分)
Ⅱ.(1)K=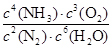 (2分)(2)>(2分)?(3)d(2分)
(2分)(2)>(2分)?(3)d(2分)
Ⅲ. (1)-572.0 kJ·mol-1(2分,单位不写不给分)?(2)①60%(2分)?②2(1分)
本题解析:Ⅰ.电解池中阳极失去电子发生氧化反应,阴极得到电子,发生还原反应。所以从总反应可以判断出H2是被氧化,应该在阳极通入,N2在阴极发生还原反应,在阴极通入,电极反应式是N2+ 6H++6e-=2NH3。
Ⅱ.(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应方程式可知,该反应的平衡常数的表达式K=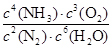 。
。
(2)曲线是在相同时间内氮气的体积分数随温度变化的关系,曲线的变化先增大后变小。温度升高反应速率加快。在此题中,反应相同时间,低温下的两点是未达到平衡的两点,随温度的升高,氮气的体积分数随温度升高而变大。曲线的最高点是某温度下达到平衡的点,之后的两点,均是平衡后的氮气的体积分数,且随温度升高而降低,这说明升高温度平衡向正方应方向移动,因此生成氮气的反应是放热反应,即此反应的正反应为吸热反应。
(3)根据(2)的结论,反应是吸热反应,应从c、d曲线中找答案。使用催化剂可以降低反应的活化能,因此应该选d。
Ⅲ.(1)反应①N2(g)+3H2(g) 2NH3(g)和反应②2N2(g)+6H2O(g)
2NH3(g)和反应②2N2(g)+6H2O(g) 4NH3(g)+3O2(g)并依据则根据盖斯定律可知,①×
4NH3(g)+3O2(g)并依据则根据盖斯定律可知,①×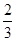 -②×
-②×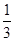 即得到反应O2(g)+2H2(g)=2H2O(g),所以该反应的反应热△H=2/3×(-93 kJ·mol-1)-1/3×1530 kJ·mol-1=-572 kJ·mol-1。
即得到反应O2(g)+2H2(g)=2H2O(g),所以该反应的反应热△H=2/3×(-93 kJ·mol-1)-1/3×1530 kJ·mol-1=-572 kJ·mol-1。
(2)①由N2(g)+3H2(g) 2NH3(g)可知,4mol的反应物完全反应,总物质的量减小2mol。因此当减少(4-2.8)mol=1.2mol时,参加反应的H2为1.8mol,所以氢气的转化率为
2NH3(g)可知,4mol的反应物完全反应,总物质的量减小2mol。因此当减少(4-2.8)mol=1.2mol时,参加反应的H2为1.8mol,所以氢气的转化率为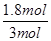 ×100%=60﹪。
×100%=60﹪。
②设氨气的物质的量是x。α1+α2=1,所以α2=40%。平衡时氨气的物质的量是1.2mol,所以消耗氨气是x-1.2mol,则x×40%=x-1.2mol,解得x=2.0mol。
本题难度:一般