微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法或表示方法正确的是( )
A.电解稀硫酸不可能发生的反应是Cu+H2SO4  CuSO4+H2↑
CuSO4+H2↑
B.李比希燃烧法、钠熔法、铜丝燃烧法、纸层析法都是元素定性分析法
C.用0.1mol/LNaOH溶液分别滴定相同物质的量浓度和相同体积的盐酸和醋酸(如图),其中实线表示的是滴定盐酸的曲线
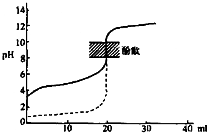
D.VLamol?L-1的氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目大于3NA
参考答案:D
本题解析:
本题难度:简单
2、选择题 下列溶液中离子浓度的关系一定正确的是( )
A.0.1mol?L-1的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-)
B.pH=3的一元酸HX溶液和pH=11的一元碱MOH溶液等体积混合:c(M+)=c(X)>c(H+)=c(OH-)
C.pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液:c(CH3COO-)>c(CO32-)>c(C6H5O-)
D.等物质的量的二元弱酸H2X与其钾盐K2X的混合溶液中:c(K+)=c(H2X)+c(HX-)+c(X2-)
参考答案:A.(NH4)2SO4溶液中,水解程度较小,则应有c(NH4+)>c(SO42-),水解显酸性,则c(H+)>c(OH-),故A错误;
B.由于酸碱的强弱不确定,则反应后溶液不一定为中性,故B错误;
C.由于CH3COONa、C6H5ONa、Na2CO3对应的酸分别是CH3COOH,C6H5OH(不是酸,显弱酸性),HCO3-,其酸为CH3COOH>C6H5OH>HCO3-.根据盐的水解,越弱越水解的原理,所以在pH相同的情况下应是:c(CH3COONa)>c(C6H5ONa )>c(Na2CO3),故C错误;
D.等物质的量的二元弱酸H2X与其钾盐K2X的混合溶液中,根据元素守恒可知n(X)=n(K),则有c(K+)=c(H2X)+c(HX-)+c(X2-),故D正确.
故选D.
本题解析:
本题难度:简单
3、简答题 下列混合溶液中,离子的浓度大小顺序正确的是( )
A.10mL0.1mol/L氨水与10mL0.1mol/L盐酸混合,c(Cl-)=c(NH4+)>c(OH-)>c(H+)
B.10mL0.1mol/LNH4Cl溶液与5mL0.2mol/LNaOH溶液混合,c(Na+)=c(Cl-)>c(OH-)>c(H+)
C.10mL0.1mol/L醋酸与5mL0.2mol/LNaOH溶液混合,c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
D.10mL0.5mol/LCH3COONa溶液与6mL1mol/L盐酸混合,c(Cl-)>c(Na+)>c(OH-)>c(H+)
参考答案:A.10mL0.1mol/L氨水与10mL0.1mol/L盐酸混合,完全反应生成NH4Cl,NH4+水解呈酸性,则有:c(H+)>c(OH-),c(Cl-)>c(NH4+)故A错误;
B.10mL0.1mol/LNH4Cl溶液与5mL0.2mol/LNaOH溶液混合,生成NaCl和氨水,反应溶液呈碱性,则有c(Na+)=c(Cl-),c(OH-)>c(H+),氨水的电子程度较低,
则有c(Cl-)>c(OH-),故B正确;
C.10mL0.1mol/L醋酸与5mL0.2mol/LNaOH溶液混合,完全反应生成CH3COONa,CH3COO-水解,溶液呈碱性,则c(Na+)>c(CH3COO-),故C错误;
D.10mL0.5mol/LCH3COONa溶液与6mL1mol/L盐酸混合,盐酸过量,溶液呈酸性,则c(H+)>c(OH-),故D错误.
故选B.
本题解析:
本题难度:一般
4、填空题 (1)25℃时,0.1mol?L-1NaOH溶液的pH为______;
(2)25℃时,0.1mol?L-1NH4Cl溶液的pH______7(填“<”、“=”或“>”),其原因是______(用离子方程式表示);
(3)将上述两种溶液等体积混合后,离子浓度大小次序正确的是______(填序号).
A.[Na+]>[Cl-]>[OH-]>[H+]
B.[Na+]=[Cl-]>[H+]>[OH-]
C.[Na+]=[Cl-]>[OH-]>[H+]
D.[Cl-]>[Na+]>[OH-]>[H+]
(4)25℃时,0.1mol?L-1 NaOH溶液中水电离出来的氢氧根的浓度为c1,0.1mol?L-1 NH4Cl溶液中水电离出来的氢离子的浓度为c2,则c1______c2(填“<”、“=”或“>”).
参考答案:(1)NaOH是强电解质,完全电离,0.1mol/L的NaOH中c(OH-)=0.1mol/L,c(H+)=KWc(OH-)=10-140.1mol/L=10-13mol/L,所以溶液的pH=13,故答案为:13;
(2)氯化铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性,则pH<7,铵根离子水解方程式为NH4++H2O?NH3?H2O+H+,故答案为:<;NH4++H2O?NH3?H2O+H+;
(3)等浓度0.1mol?L-1等体积的NaOH和NH4Cl溶液混合,二者恰好反应生成等浓度0.05mol/L的NaCl和NH3?H2O,一水合氨电离导致溶液呈碱性,所以[OH-]>[H+],根据物料守恒得[Na+]=[Cl-],一水合氨电离程度较小,所以[Cl-]>[OH-],则溶液中离子浓度大小顺序是[Na+]=[Cl-]>[OH-]>[H+],故选C;
(4)酸或碱抑制水电离,含有弱离子的盐促进水电离,NaOH抑制水电离,氯化铵促进水电离,所以c1<c2,故答案为:<.
本题解析:
本题难度:简单
5、填空题
在纯碱溶液中滴入酚酞,所观察到的现象是 _______________________________________,
若在该溶液中逐滴加入过量的氯化钙溶液,所观察到的现象是________________________________,
其原因是(以离子方程式和简要文字说明):_______________________________________________。
参考答案:溶液变红;溶液中生成了白色的沉淀,溶液红色变浅直到退去;纯碱溶液中滴入酚酞,由于CO32-水解溶液显碱性,使溶液呈红色,CO32-+H2O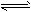 HCO3-+OH-;当向溶液中滴入过量的氯化钙溶液,Ca2+结合CO32-生成了白色的CaCO3沉淀,Ca2++CO32-==CaCO3↓,使CO32-水解平衡向左移动,溶液的碱性变弱,溶液的红色变浅,直至退去
HCO3-+OH-;当向溶液中滴入过量的氯化钙溶液,Ca2+结合CO32-生成了白色的CaCO3沉淀,Ca2++CO32-==CaCO3↓,使CO32-水解平衡向左移动,溶液的碱性变弱,溶液的红色变浅,直至退去
本题解析:
本题难度:一般