微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (14分)某研究性学习小组用下列装置(铁架台等支撑仪器略)探究氧化铁与乙醇的反应,并检验反应产物。
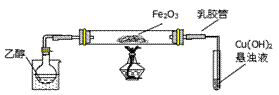
(1)为快速得到乙醇气体,可采取的方法是?;若实验时小试管中的溶液已经开始发生倒吸,你采取的措施是 _________(填写编号);
a.取下小试管 ?b.移去酒精灯
c.将导管从乳胶管中取下? d.以上都可以
(2)盛Cu(OH)2悬浊液的试管中可能出现的现象为___________________。
(3)如图实验,观察到红色的Fe2O3全部变为黑色固体(M),充分反应后停止加热。为了检验M的组成,进行下列实验。
① M能被磁铁吸引;加入足量稀硫酸,振荡,固体全部溶解,未观察到有气体生成;
② 经检验溶液中有Fe2+和Fe3+;
关于M 中铁元素价态的判断正确的是?(填写编号)。
a.一定有+3价和+2价铁,一定无0价铁? b.一定有+3价、+2价和0价铁
c.一定有+3价和0价铁,一定无+2价铁? d.一定有+3和+2价铁,可能有0价铁
(4)若M的成份可表达为FeXOY,用CO还原法定量测定其化学组成。称取a g M样品进行定量测定,实验装置和步骤如下:
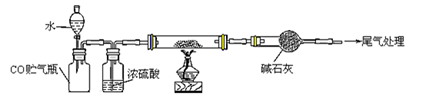
① 组装仪器;②点燃酒精灯;③加入试剂; ④打开分液漏斗活塞;⑤检查气密性;⑥停止加热;⑦关闭分液漏斗活塞;⑧……。正确的操作顺序是__________(填写编号)
a.①⑤④③②⑥⑦⑧? b.①③⑤④②⑦⑥⑧ c.①⑤③④②⑥⑦⑧ d.①③⑤②④⑥⑦⑧
(5)若实验中每步反应都进行完全,反应后M样品质量减小b g,则FeXOY中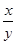 =_____。
=_____。
参考答案:(1)在烧杯中加入热水(对烧杯加热)(2分)? c? (2分)? (2)试管中出现砖红色沉淀(2分)
(3)?d? (2分)? (4)c? (2分)? (5) 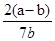 ?(4分)
?(4分)
本题解析:(1)乙醇的沸点比较低,只有78℃,因此为快速得到乙醇气体,可采取的方法是在烧杯中加入热水(对烧杯加热)。阻止倒吸的操作是迅速拆下导气管,因此若实验时小试管中的溶液已经开始发生倒吸,你采取的措施是将导管从乳胶管中取下,答案选c。
(2)乙醇蒸气在氧化铁做催化剂作用下生成乙醛,试管内发生的是乙醛和氢氧化铜加热反应生成红色氧化亚铜沉淀,因此盛Cu(OH)2悬浊液的试管中可能出现的现象为试管中出现砖红色沉淀。
(3)M能被磁铁吸引,说明含有铁或四氧化三铁。由于反应后铁离子过量,因此即使有铁生成,也不可能与稀硫酸反应生成氢气,因此M 中铁元素价态是一定有+3和+2价铁,可能有0价铁,故答案选d。
(4)实验过程依据反应原理和实验目的分析实验步骤为,组装装置,检验装置气密性,加入试剂,加入水把一氧化碳赶入后续装置,点燃酒精灯加热玻璃管,反应结束后停止加热,关闭分液漏斗活塞,玻璃管称量剩余固体,依据质量变化计算铁元素和氧元素物质的量之比,所以选c。
(5)依据实验结果得到,铁的氧化物中减少的质量为氧元素的质量为bg,铁的质量为(a-b)g,依据元素物质的量计算得到比值,n(Fe):n(O)= ?=
?=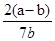 。
。
本题难度:一般
2、实验题 【选修2-化学与技术】(15分)
“烂版液”是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量的Cl-、Fe3+),某化学兴趣小组拟用“烂版液”制取Zn(NO3)2·6H2O的过程如下:?
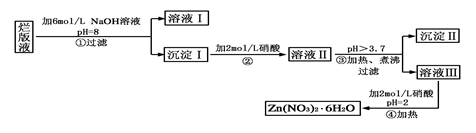
已知:Zn(NO3)2·6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物具有两性。
(1)“烂版液”中溶质的主要成分是________(填化学式),若稀硝酸腐蚀锌板产生的气体为N2O,写出稀硝酸腐蚀锌板反应的主要化学方程式______________________。
(2)在操作①中保持pH=8的目的是_________________________________。
(3)沉淀Ⅰ的主要成分是___________________________________________。
(4)操作③中加热、煮沸的目的是___________。此步骤操作的理论依据是_______________。
(5)操作④保持pH=2的目的是_______。此步骤操作中所用的主要仪器是_____ ______。
参考答案:(1)Zn(NO3)2 ?(1分)4Zn+10HNO3=4Zn(NO3)2+N2O↑+5H2O (2分)
(2)防止生成的Zn (OH)2沉淀被溶解(2分)
(3)Zn(OH)2和Fe(OH)3 (2分)
(4)促使Fe3+完全水解 温度越高,水解程度越大(2分)
(5)抑制Zn2+水解为Zn(OH)2 ?(2分)
蒸发皿、酒精灯、铁架台、玻璃棒(4分)
本题解析:根据题意知,“烂板液”中含有大量的锌离子、氢离子、硝酸根离子和少量的Cl-、Fe3+,加入氢氧化钠调节溶液的PH=8使铁离子、锌离子完全沉淀,然后在沉淀Ⅰ中加硝酸溶解,溶液Ⅱ中含有大量锌离子、氢离子、硝酸根离子和少量的铁离子,调节溶液的PH使铁离子沉淀,溶液Ⅲ是硝酸锌溶液,在酸性条件下加热浓缩、冷却结晶,得到Zn(NO3)2?6H2O晶体。(1)烂板液”中溶质的主要成分是Zn(NO3)2,稀硝酸腐蚀锌板产生N2O、硝酸锌和水,化学方程式为4Zn+10HNO3=4Zn(NO3)2+N2O↑+5H2O;(2)在操作①中保持pH=8的目的是使锌离子完全转化为氢氧化锌,PH不大,如果PH加大氢氧化锌两性又溶解,答案为:防止生成的Zn(OH)2溶解;(3)Zn2+、Fe3+完全沉淀生成相应的氢氧化物,答案为:Fe(OH)3、Zn(OH)2;(4)加热、煮沸促使Fe3+完全水解,原理是温度越高,水解程度越大,答案为:促使Fe3+完全水解、温度越高,水解程度越大;(5)锌离子易水解生成氢氧化锌,酸性条件下可抑制锌离子的水解,操作④包括蒸发浓缩,冷却结晶,过滤,所用的主要仪器有蒸发皿、酒精灯、铁架台、玻璃棒,答案为:抑制Zn2+水解生成Zn(OH)2;蒸发皿、酒精灯、铁架台、玻璃棒。
本题难度:一般
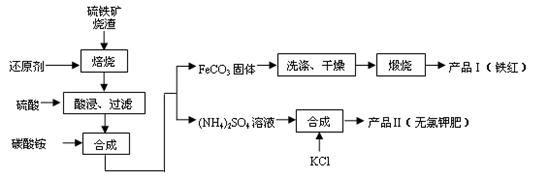
3、实验题 (9分) 硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2 等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用硫铁矿烧渣制备铁红等产品的实验流程如下:
等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用硫铁矿烧渣制备铁红等产品的实验流程如下:
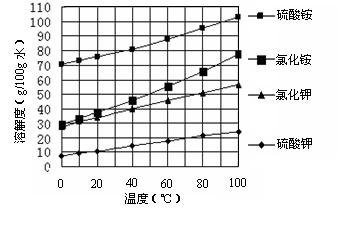
已知几种盐的溶解度随温度变化的曲线如下图所示:
回答下列问题:
(1)酸浸、过滤后滤液中的金属阳离子是________________。
(2)煅烧FeCO3生成产品I的化学反应方程式为________________________________。实验室进行煅烧操作所需仪器除了酒精灯、泥三角、三脚架、玻璃棒外,还有__________。
(3)产品Ⅱ的化学式为_______________,为了获得产品Ⅱ,向(NH4)2SO4溶液中加入KCl溶液后,还需要进行的操作是:?。
(4)检验产品II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液,滴加过量Ba(NO3)2溶液,过滤后向滤液滴加硝酸酸化的AgNO3溶 液。判断Ba(NO3)2已过量的方法是?。
液。判断Ba(NO3)2已过量的方法是?。
参考答案:(1)Fe2+(1分)
(2)4FeCO3+O2 2Fe2O3+
2Fe2O3+ 4CO2?(2分)?坩埚、坩埚钳(1分)
4CO2?(2分)?坩埚、坩埚钳(1分)
(3)K2SO4?(1分)?蒸发结晶、趁热过滤、洗涤、干燥(2分)
(4)取少许滤液于另一试管中,再滴入1~2滴H2SO4溶液,若溶液变浑浊。则表明Ba(NO3)2已过量。(2分) 其它合理也行
本题解析:略
本题难度:一般
4、实验题 (11分)某实验小组欲制取氧化铜并证明其能加快氯酸钾的分解,进行如下实验:
I.制取氧化铜
①称取2gCuSO4·5H2O研细后倒人烧杯,加10 mL蒸馏水溶解;
②向上述CuSO4溶液中逐滴加入NaOH 溶液。直到不再产生沉淀,然后将所得混合物转
溶液。直到不再产生沉淀,然后将所得混合物转 移到蒸发皿,加热至沉淀全部变为黑色;
移到蒸发皿,加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤,晾干后研细备用。
回答下列问题:
(1)上述实验步骤中需要使用玻璃棒的是?(填实验序号),步骤①、③中研磨固体所用仪器的名称是?。
(2)步骤③中洗涤沉淀的操作是?。
Ⅱ.证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较。实验时均以生成25 mL气体为准,其他可能影响实验的因素均已忽略,相关数据见下表:
实验序号
| KClO3质量
| 其他物质的质量
| 待测数据
|
④
| 1. 2g 2g
| 无其他物质
| ?
|
⑤
| 1. 2g
| Cu O? 0.5g O? 0.5g
| 
|
⑥
| 1. 2g
| MnO2? 0.5g
| ?
|
?回答下列问题:
(3)上述实验中的“待测数据”指?。
(4)若要证明实验中产生的气体是O2,可用小试管收集气体,后续操作为?。
(5)为探究CuO在实验⑤中是否起催化作用,需补做如下实验(无需写出具体操作):
a.?。b. CuO的化学性质有没有改变。
参考答案:
(1)①②③?(2分,全对得满分,漏选得1分。)?研钵(1分,多答“杵”不扣分)
(2)沿玻璃棒向过滤器中的沉淀里加蒸馏水至淹没沉淀 ,静置过滤,重复2~3次(2分)
,静置过滤,重复2~3次(2分)
(3)产生25 mL气体的时间(2分)
(4)取一根带火星的木条,伸入小试管内,若木条复燃则产生的是O2(2分)
(5)CuO的质量有没有改变(2分)
本题解析:略
本题难度:一般
5、实验题 (8分)用如图所示的装置进行制取NO实验(已知Cu与HNO3的反应是放热反应)。
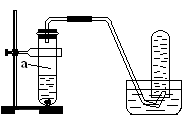
(1)在检查装置的气密性后,向试管a中加入10ml 6 mol·l-1稀HNO3和1gCu片,然后立即用带导管的橡皮塞塞紧试管口。请写出Cu与稀HNO3反应的化学方程式:_______________________________________________________。
(2)实验过程中通常在开始反应时反应速率缓慢,随后逐渐加快,这是由于
_________________________________________________; 进行一段时间后速率
又逐渐减慢,原因是______________________________________________。
(3)欲较快地制得NO,可采取的措施是_____________。
A.加热
B.使用铜粉
C.稀释HNO3
D.改用浓HNO3
参考答案:(1)3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
(2)反应放热,使温度升高,反应速率加快;反应一段时间后,硝酸的浓度减小了,反应速率又逐渐减慢。?(3)AB
本题解析:(1)稀硝酸具有强氧化性,和铜反应生成硝酸铜、NO和水。
(2)影响反应速率的因素一般是温度和浓度等。随反应的进行,浓度是降低的,但反应速率是逐渐加快的,说明在反应过程中,温度升高导致反应速率加快的,即该反应是放热反应。当反应进行到一定程度时,硝酸的浓度降低,此时浓度的影响超过了温度对反应速率的影响,因此反应速率又降低。
(3)根据外界条件对反应速率的影响,要加快反应速率可以通过升高温度,或增大反应物的接触面积。C是稀释硝酸,浓度降低,反应速率降低。浓硝酸和铜反应的还原产物是NO2。所以正确的答案是AB。
本题难度:一般